중흥기를 맞이한 유전자치료제가 올해 상반기에만 4품목이 FDA 승인대기 중이다. 첫 승인결은 60억원대 약가로 글로벌시장에서 최고가 치료제인 리브멜디로 시작된다.
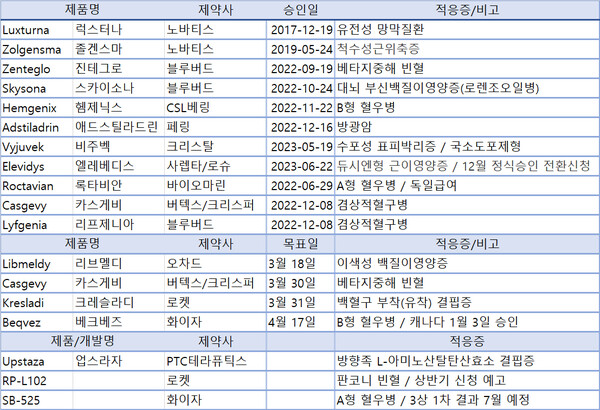
유전자치료제는 노바티스의 럭스터나(17년)와 졸겐스마(19년) 이후 22년 4품목, 23년 5품목을 승인받으며 인지하지 못하는 사이 FDA 승인신약 비중 10%에 근접했다. 올해도 FDA승인거부 등이 발생하지 않는 한 그 기세를 유지할 전망이다.
뉴스더보이스가 FDA의 유전자치료제 승인현황과 업체 공시 및 발표 등을 분석한 결과 지난해까지 모두 11개 치료제가 승인을 받았으며 올해 상반기에만 4 품목의 FDA 승인목표예정일이 설정돼 있다. 또한 최소 3건의 승인신청 가능폼목이 식별됐다.
유전자치료제로 FDA 승인일정이 가장 빠른 품목은 오차드 테라퓨틱스의 이색성 백질이영양증 치료제 리브멜디(Libmeldy, atidarsagene autotemcel)다. 승인목표예정일은 3월 18일로 설정돼 있다.
20년 12월 유럽승인을 먼저 받은 품목으로 이탈리아의 급여 표시가격은 474만 5천 유로로 60억원대 치료제다. 극희귀질환 치료제로 유럽국가별로 연간 치료가능 환자 수는 2~3명 수준이다.
다음으로는 지난해 12월 겸상적혈구병치료제로 승인받은 버텍스와 크리스퍼의 카스게비(Casgevy, exagamglogene autotemcel)의 베타지중해 빈혈 승인결정이 이뤄진다. 목표일은 3월 30일로 설정됐다.
크리스퍼(CRISPR) 유전자 편집기술을 활용한 첫 치료제인 카스게비는 영국에서 가장 먼저 두가지 적응증 모두에 대해 승인을 받은 바 있어, 별도의 상품명이 적용되지는 않을 것으로 전망된다.
바로 다음날인 3월 31일에는 로켓 파마슈티컬스의 백혈구 부착(유착) 결핍증(LAD) 유전자치료제 후보 RP-L201(marnetegragene autotemcel) 승인결정이 진행된다.
상품명은 크레슬라디(Kresladi)로 최근 정해졌으며 LAD는 상처부위에 백혈구가 부착하지 치유가 지연되고 백혈구가 과증식해 적절한 치료가 이뤄지지 않는 경우 사망에 이르게 되는 소아희귀질환이다.
2분기에는 화이자의 B형 혈우병치료제 베크베즈(Beqvez, fidanacogene elaparvovec)의 승인 일정이 잡혀있다. 4월 17일 이며 화이자는 지난 3일 캐나다에 첫 규제승인 성공소식을 전했다.
경쟁품목은 CLS의 헴제닉스로 승인시 겸상적혈구병, 베타지중해 빈혈 등에 이어 유전자치료제간 경쟁구도가 형성된다.
<24년 승인신청서 제출 추정 품목>
승인신청이 가장 유력한 폼목은 PTC테라퓨틱스의 업스타자(Upstaza/eladocagene exuparvovec)로 희귀 유전성 신경질환인 방향족 L-아미노산탈탄산효소 결핍증(AADC) 치료제다.
22년 유럽과 영국에서 승인을 받은 품목으로 PTC는 지난 3분기 실적보고 공시를 통해 12월 FDA와 승인신청 관련 회의를 갖을 계획이라고 발표한 바 있다. 문제는 임상과 상용용량이 다르다는 점인데 용량을 일치시킨 2상(NCT04903288) 데이터를 통해 이를 보완, 신청서를 제출한다는 계획이다.
로켓 파마슈티컬은 3분기 실적보고를 통해 판코니 빈혈(Fanconi anemia) 치료제 후보 RP-L102의 FDA 및 유럽 승인신청서 제출을 예고했다. 당초 지난해 4분기 승인신청 계획이라고 발표한 바 있으나 지연됐다.
앞서 3월 31일 승인목표예정일이 잡힌 레슬라디의 FDA 승인검토와 연관되어 승인신청서 제출 및 수락여부가 판명될 것으로 예측된다.
화이자의 A형 혈우병치료제 SB-525(PF-07055480/giroctocogene fitelparvovec)의 승인신청서 제출 가능성도 높게 예상된다. Alta 1/2상(NCT03061201) 104주 장기효과가 공유된 바 있으며 3상(NCT04370054) 1차 평가변수 분석도 올해 중반 진행된다.
다만 12월 FDA와 유럽승인신청서가 제출된 마르타시맙(Marstacimab) 등 화이자의 혈우병치료를 위한 3가지 개발품목중 부작용 이슈로 인해 개발 및 규제승인 추진속도가 가장 늦다.
한편 모두 11품목이 FDA 승인을 받으면서 CAR-T 중심 세포치료제 보다 더 많은 품목이 승인을 받았다. 규제승인에 빨라진 속도에 비해 미국시장이외 유럽을 포함한 글로벌 시장에서 높은 약가로 인해 급여문턱을 넘는데는 어려움이 이어지고 있다.