국내뿐만 아니라 해외가 운영중인 의약품 특허권 존속기간 연장제도는 어떻게 운영되고 있을까.
식약처는 매년 주요 국가의 특허권 존속기간 연장제도에 따른 여러 판례를 소개하고 있다.
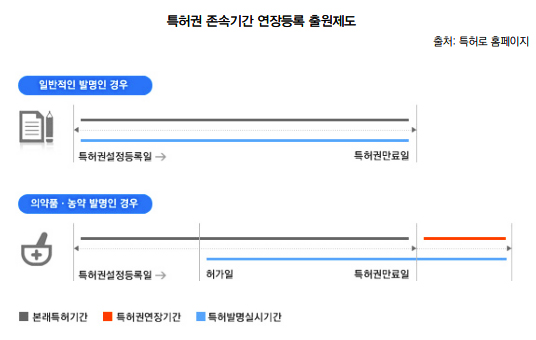
여기서 의약품 특허권 존속기간 연장제도는 특허 발명 실시를 위해 관련 기관의 허가, 등록을 수행하는 과정을 거침에 따라 특허권자가 발명을 실시할 수 없는 기간을 법적으로 보장해주기 위해 실시되고 있는 제도를 의미한다.
국내외 연장제도를 살펴보면 먼저 국내 특허권 존속기간은 특허출원일로부터 20년이 되는 날까지로 정하고 있으며, 등록지연에 따른 존속기간의 연장과 허가 등에 의한 존속기간 연장이 존재한다.
등록지연에 따른 특허권의 존속기간연장(Patent Term Adjustment-PTA)은 한미 FTA 발효부터 시행된 것으로 특허출원일부터 4년과 출원심사 청구일부터 3년 중 늦은 날보다 지연돼 특허권의 설정등록이 이루어지는 경우 지연기간만큼 해당 특허권 존속기간을 연장할 수 있는 제도이다.
허가 등에 따른 특허권 존속기간 연장제도(Patent Term Extension-PTE)는 1987년 물질특허제도 도입시 함께 도입된 제도로 특허발명 실시를 위해 약사법 등 허가나 등록을 받아야하는 경우, 안전성 및 유효성 등의 시험으로 소요되어 발명을 실시할 수 없는 기간에 대해 해당 특허의 존속기간을 5년의 기간까지 한차례 연장해 주는 제도이다.
미국의 의약품 특허권 존속기간 연장제도는 미국의 특허권 존속기간은 USPTO의 절차에 의한 심사지연으로 특허 등록 기간을 연장시켜주는 제도(PTA)와 의약품의 특성상 FDA 허가나 등록절차가 필요한 경우, 특허권자의 권리를 보장하기 위해 의약품 특허 존속기간 연장제도(PTE)를 시행하고 있다.
USPTO의 PTA(Patent Term Adjustment)는 특허 등록까지 3년 이상이 소요된 경우에 대해 절차지연에 따라 3년을 초과한 일수를 연장시켜주고 있으며, 출원인에 의해 지연된 기간은 인정하지 않고 있다.
미국은 PTE(Patent Term Extension)에 대해 의약품, 의료기기, 색소 첨가물 및 식품 첨가물에 대해 특허 기간을 연장하고 있는 제도를 시행중이며, 특허기간의 연장은 FDA에 의해 산정된 심사기간에 근거해 USPTO가 연장기간 규제검토기간에 근거 산정하며 연장기간은 (X-D1)x1/2+(Y-D2)로 계산된다. 여기서 X는 임상시험기간, D1는 임상시험기간 중 권리자의 귀책으로 지연된 기간, Y는 FDA 검토기간, D2는 FDA 검토기간 중 권리자의 귀책으로 지연된 기간이다.
PTE의 출원은 승인일로부터 60일 이내 1회 신청가능하며, 최대 5년을 초과할 수 없고, 연장기간을 포함한 총 특허 존속 기간이 허가 후 14년을 초과할 수 없다.
유럽의 경우 유럽의 특허권 존속기간 연장과 관련된 제도는 SPC(Supplementary Protection Certificate)가 있으며, SPC는 1992년 도입돼 Council Regulation (EC) 469/2009에 의해 운영되고 있다.
유럽의 SPC는 제품에 관한 물질, 제법, 용도 특허 중 1개의 특허만을 1회 신청이 가능하며, 기간의 산정은 특허출원일부터 유럽내 최초 시판 승인일까지의 기간을 5년내에서 산정한 기간이다. SPC제도는 특허권 자체의 존속기간 연장의 개념이 아닌, 특허권 만료 후 SPC와 같은 독점판매권리를 부여해 특허권자의 특허권리를 보장하고 있다.
일본은 해당 연장제도가 1988년 도입됐으며, 국내 특허법과 마찬가지로 등록지연에 따른 존속기간 연장과 허가 등에 의한 존속기간 연장 제도로 구분할 수 있다.
일본의 특허권 등록지연에 따른 존속기간의 연장(PTA)은 일본 특허법 제67조 제2항에 근거해 연장등록의 출원에 의해 특허 존속기간을 연장할 수 있음을 규정하고 있다. PTE(Patent Term Extension)에 대하여 사람 또는 동물용 의약품 및 농약을 대상으로 하며, 물질특허, 제법특허, 용도특허 각각에 대해 5년을 한도로 복수의 존속기간 연장 신청이 가능한 특징을 가지고 있다.
중국은 2021년 6월 1일 기준 특허법 4차 개정을 진행했으며, 제42조 의약품 존속기간의 보상제도를 신설했다. 마찬가지로 중국은 등록지연에 따른 존속기간의 연장과, 의약품의 허가 및 심사에 따른 존속기간의 보상제도를 시행하고 있으며, 총 존속기간은 최대 5년이며, 판매독점권 승인일로부터 14년을 초과할 수 없다.
호주는 여타 국가와 마찬가지로 의약품 특허권 존속기간 연장제도를 시행하고 있다.
호주의 의약품 특허존속기간 연장 조건은 호주 특허법 제70에 규정된 바에 의거해 특허청구범위에 포함된 특허를 통해 실질적으로 공개된 의약물질 또는 재조합 DNA 기술을 사용하는 방법에 의해 생산된 하나 또는 그 이상의 의약물질, 호주식약청(TGA)의 데이터베이스(ARTG)에 포함된 의약물질 및 의약물질로 구성되는 제품, 해당 물질의 특허출원일로부터 의약품 승인일까지 최소 5년 이상이 소요된 경우에 한해 신청할 수 있다.
관련 특허 1건에 대해 최대 5년이내 1회 연장이 가능하며, 의약물질로 재조합 DNA를 사용한 의약물질을 포함하는 특징을 가지고 있다.
캐나다는 2017년 9월 21일 발효된 캐나다와 EU간 CETA(Comprehensive Economic and Trade Agreement)에 의해 CSP(Certificate of Supplementary Protectio)를 도입해 특허 발명의 존속기간을 보호하고 있다.
CSP제도는 인간용 및 동물용 의약품을 대상으로 하며, 판매 허가된 의약품의 특허중 하나의 특허에 대해 CSP를 신청할 수 있으며 연장기간은 산출 공식 연장기간의 경우 판매승인일에서 특허출원일을 뺀 기간에서 5년을 제외하는 계산으로 최장 2년간 연장할 수 있다.
이밖에 인도의 경우 존속기간 연장제도를 시행하고 있지 않으며 싱가포르는 특허법 제36A조에 의거해 등록당시 등록관에 의한 부당한 등록지연, 출원 및 등록시 심사결과 등 특허 등록 이행과 관련한 문제를 이유로 등록이 지연된 경우, 출시 의약품에 있어 유효성분을 포함하는 특허의 경우 1회에 한해 판매승인까지의 과정에 있어 소요된 시간을 보장하고 있다.



