첨단바이오의약품을 제조-수입-위탁판매업자의 경우 3년 주기 허가증을 갱신해야 한다.
식품의약품안전처(처장 오유경)는 '첨단재생바이오법'에서 정한 업허가(신고)증 갱신제도 운영에 필요한 세부 사항을 규정한 '인체세포등 및 첨단바이오의약품 업허가 갱신에 관한 규정')을 8월 14일 제정·시행한다고 밝혔다'
업허가(신고)증 갱신제도는 세포처리시설의 장, 인체세포등 관리업자, 첨단바이오의약품 제조·수입·위탁제조판매업자를 주기적으로 점검·관리하여 세포·조직 등의 품질과 안전을 촘촘하게 관리하기 위해 허가(신고)증을 3년 주기로 갱신하는 제도이다.
이번에 제정한 고시는 업허가(신고)증 갱신제도 운영에 필요한 갱신 신청절차, 제출서류 범위, 자료보완 절차 등을 규정했다.
먼저 갱신 신청절차와 제출서류의 범위 규정의 경우 세포처리시설의 장, 인체세포등 관리업자는 허가증 유효기간 종료 120일 전까지, 첨단바이오의약품 제조·수입·위탁제조판매업자는 허가(신고)증의 유효기간 종료 60일 전까지 갱신을 신청해야 한다.
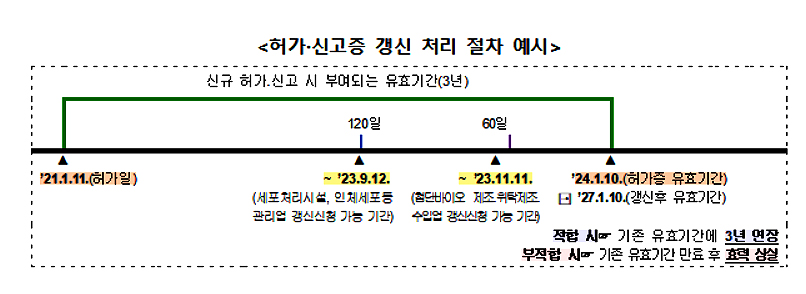
또 갱신신청 시 허가(신고)증 원본과 갱신기준에 충족함을 입증할 수 있는 자료를 제출해야 한다.
세포처리시설·인체세포등 관리업의 경우 사업계획서, 시설·장비 목록, 인력 현황, 인체세포등 공급 실적(첨단바이오의약품 제조·수입·위탁제조판매업) 제조소 총람, 시설·장비 목록, 제조(수입) 실적 등을 제출해야 한다.
갱신 유효기간 산정 방법, 갱신기준, 자료보완 절차 등을 규정했다.
유효기간 산정은 허가(신고)증 갱신 후 유효기간은 기존 유효기간 만료일부터 3년 후로 연장된다. 갱신기준의 경우 해당 업체의 시설·인력·장비 기준, 업무 수행 실적, 첨단재생바이오법, 약사법 준수 여부 등을 확인한다.
자료보완 절차는 자료의 보완이 필요한 경우 갱신 신청일부터 40일(제조·수입·위탁제조판매업은 20일) 이내에 보완을 요청할 수 있다.
식약처는 "이번 고시 제정이 첨단바이오의약품과 인체세포등의 품질을 확보하고 환자에게 안전한 의약품을 제공하는 데 도움을 줄 것"이라며 "앞으로도 첨단재생의료 분야에서 안전하고 효과적인 치료제가 국민에게 공급될 수 있도록 최선을 다해 노력하겠다"고 밝혔다.



