강현경 식약처 연구관, 13일 의약품심사업무 온라인 설명회서 소개
의약품 허가 후 제조방법 변경관리 시점, 대상 등은 어떻게 이뤄질까.
강현경 식약처 의약품심사부 의약품규격과 연구관은 13일 열린 '의약품 심사업무 온라인 설명회'에서 의약품 허가 후 제조방법 변경관리에 대한 민원인 궁금증을 설명했다.
강 연구관은 이날 사전질의 응답을 통해 허가 후 제조방법 변경관리 적용 시점이 오는 11월12일 이후 적용된다고 밝혔다.
또 원료의약품 사항도 포함되는 지에 대해 완제약의 S파트로서 변경관리 대상에 들어간다고 덧붙였다.
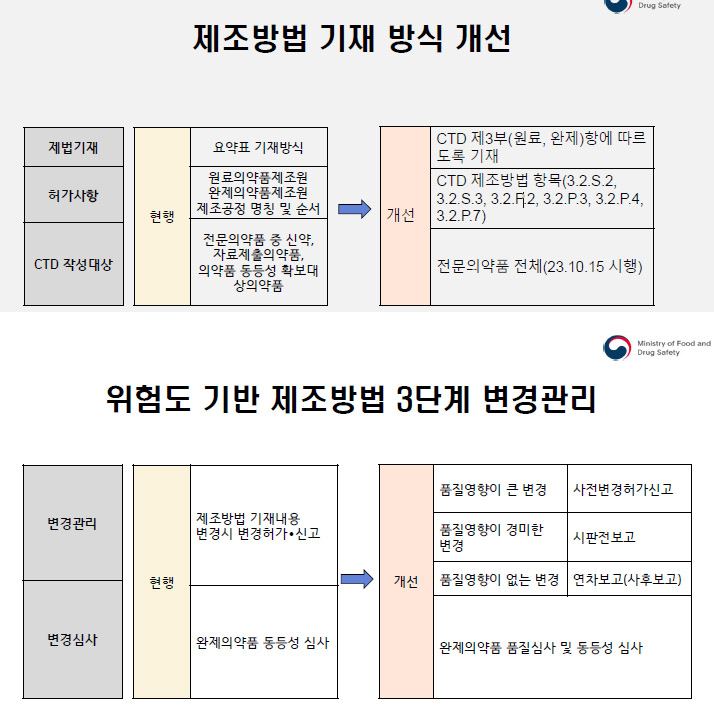
허가 후 제조방법 변경관리 가이드라인 제정 시, 완제의약품 중심 질의응답의 원료의약품 등록과 관련된 변경사항들도 반영되는 것에 대해, 의약품 허가 후 제조방법 가이드라인의 적용범위는 CTD작성 대상 완제의약품의 제조에 관한 항목(CTD제3부 품질평가 자료 중 3.2.S.2, 3.2.S.3, 3.2.P.2, 3.2.P.3, 3.2.P.4, 3.2.P.7)을 변경하고자 하는 경우 적용되며, 원료의약품(DMF) 변경사항은 적용범위가 아니라고 밝혔다.
또 협회를 통해 허가 후 제조방법 변경 가이드라인(안)에 대한 의견은 수용가능한 의견을 반영해 가이드라인(안)이 수정됐다고 덧붙였다.
이밖에도 허가 후 제조방법 관리 중 제조방법의 CTD 대상 품목 관련해 지난 2016년 3월 20일 CTD 확대 이전에 허가 받은 품목으로서 변경민원이 없었거나 있어도 일부만 CTD화해 허가변경을 진행했을 경우, 22년 11월 이후 허가변경 진행 시 CTD3부를 전체로 제출해야 하는지 혹은 이전 방식과 동일하게 변경되는 부분부터 순차적으로 적용하면 될지 대해서 답변을 했다.
그는 CTD 작성대상 완제의약품 제조에 관한 항목(CTD 3부 품질자료 중 3.2.S.2, 3.2.S.3, 3.2.P.2, 3.2.P.3, 3.2.P.4, 3.2.P.7)은 허가증의 제조방법 첨부문서에 해당되므로 일부분이 아닌 전체 자료를 구비해야 한다고 설명했다.



