코로나19와 인플루엔자를 동시에 진단하는 시약이 허가됐다.
식품의약품안전처는 3일 코로나19-인플루엔자 동시진단 시약 1개 제품을 정식 허가했다고 밝혔다.
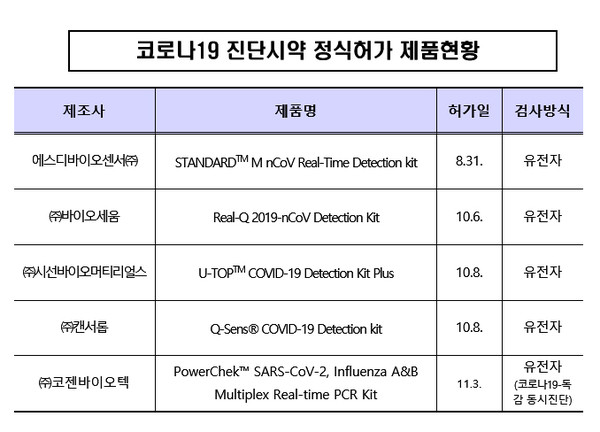
코젠바이오텍의 'PowerChek™ SARS-CoV-2, Influenza A&B Multiplex Real-time PCR Kit'가 허가됐으며 유전자 검사방식이다.
이번에 허가받은 동시진단 시약은 기침, 인후통 및 발열 등 증상이 비슷해 구분이 쉽지 않은 코로나19와 인플루엔자를 동시에 진단할 수 있는 제품이다.
이 제품으로 의심 환자의 검체를 검사하는 경우 한 번의 검사로 3~6시간 이내에 진단결과를 동시에 얻을 수 있어, 검사시간을 단축시키고 빠른 시간 내에 적절하게 처치할 수 있게 되는 등 환자의 편의성을 제고하고 의료인의 부담을 덜 수 있다는데 큰 의미가 있다는 게 식약처의 설명이다.
식약처는 코로나 19 유전자 진단시약 5개를 허가했다.
3일 기준 정식허가를 신청한 진단시약은 유전자 진단시약 14개, 항원 진단시약 5개, 항체 진단시약 11개로 총 30개 제품이 심사 중에 있다.
한편, 코로나19 진단시약 수출 현황을 보면 197개 제품(유전자 100, 항원 27, 항체 70)이 수출용 제품으로 허가돼 지난달 27일 기준 인도, 미국, 브라질, 이탈리아, 인도네시아, 네덜란드 등 전 세계 160여개 국가에 총 3억4723만명분을 수출했다.
수출금액은 9월까지 약 1조3,956억원(12억2백만불)으로, 이는 2020년 코로나19 판데믹으로 새롭게 창출된 수출규모이며, 2019년 체외진단시약 전체 수출액 4,855억원과 비교하더라도 187% 증가한 것이며, 연말까지는 200%를 상회할 것으로 예상되고 있다.



