코르티코스테로이드 부데소니드 경구현탁액 '엘로히라'

다케다는 부데소니드 경구현탁액 '엘오힐리아(Eohilia)'가 호산구식도염 치료 적응증으로 FDA 승인을 받았다고 12일 발표했다.
엘로힐리아는 천신치료제로 널리 알려진 코로티코스테로이드 부데소니드의 제형변경 량신약으로 11세 호산구식도염을 적응증으로 하는 첫 경구치료옵션이 됐다. 다만 12주간 단기 치료요법으로 사용토록 제한됐다.
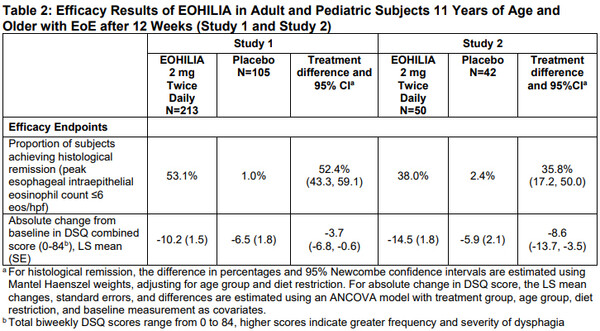
승인은 위약대비 1일 2회 엘로힐리아 투약군의 12주차에 조직학적 관해 달성 비율 등 호산구식도염의 개선효과를 제시한 2건의 3상(NCT02605837/NCT01642212)이 기반이 됐다.
엘로힐리아는 지난 21년 1월 엘로힐리아에 대한 승인신청에 대해 FDA로 부터 완결된 응답서신을 접수받아 한차례 승인 거부된 바 있다. 이후 23년 9월 단기치료 적응증으로 재승인신청에 대해 수락된 이후, 이번에 승인받게 됐다.
다케다는 "그간 코르티코스테로이드 제제가 호산구식도염 환자를 위해 다양한 형태의 오프라벨 처방과 투약이 이뤄져 왔다" 며 "엘로힐리아는 점성상태를 유지, 호산구성 식도염 치료효과를 높이도록 고안된 부데소니드 경구현탁액으로 약물을 삼키기 어려운 환자를 위한 승인된 치료옵션을 제공하게 됐다" 고 설명했다.
호산구식도염 치료제로는 사노피의 듀피젠트가 첫 치료제로 FDA 승인을 받은 바 있다. 올해 1월 26일는 1세이상 환자까지 적응증을 추가 확대했다. 엘로힐리아는 듀피젠트 이전 단기투약 역할을 부여받았다.
저작권자 © 뉴스더보이스헬스케어 무단전재 및 재배포 금지



