최근 10여년간 FDA 승인을 받은 피부과 약물의 절반 가까이는 동급최초(First in Class) 또는 최초 적응증 타이틀을 갖는 등 혁신의 시대를 맞이했다는 평가가 나왔다.
자마 피부과에 존슨 홉킨스 의대 라비 굽다(교신저자) 박사 연구진이 최근 발표한 분석에 따르면 2012년부터 2022년까지 FDA 승인을 받은 52품목과 추가적응증 신청 26건을 살핀 결과, 신약중 11품목(21%)가 동급 최초, 13품목(25%)이 최초 적응증으로 분류됐다.
즉 최근 10년간의 피부질환 치료 신약의 거의 절반에 가까운 약물은 피부감염, 아토피피부염, 흑색종 등 특정 피부질환 치료를 위한 새로운 작용기전의 동급최초 신약이거나 치료제가 없던 질환에 대한 첫 치료제 등으로 이전 세대에 비해 큰 혁신이 이뤄졌다는 분석이다.
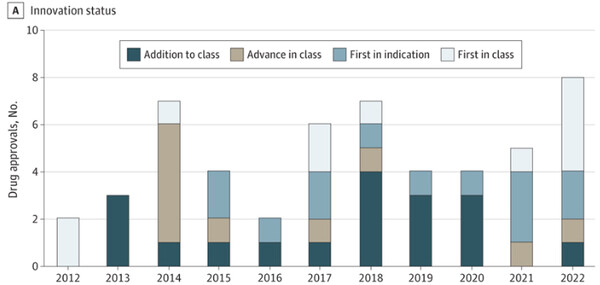
특히 피부과 약물 개발은 낮은 수익 잠재력과 위험 대비 이익율로 인해 개발 약물의 수가 적고 혁신신약의 승인빈도가 낮았다는 점에서 고무적인 변화로 평가했다.
연구진은 FDA 승인기준에 더해 또한 캐나다, 독일, 프랑스의 의료기술평가(HTA) 기준으로도 52개 신약중 15개 품목(39%)는 임상적으로 유용하거나 기존치료제 대비 높은 치료이점이 있는 것으로 평가됐으며 10개의 추가적응증중 3개(30%)는 같은 이점이 있는 것으로 평가를 받아, 주요국가에서도 유사한 평가가 이뤄졌다고 덧붙였다.
이는 피부과 국소도포 약물의 2000년부터 2014년까지 FDA 승인현황 분석연구( 10.1001/jamadermatol.2015.0231) 등 이전 연구자료의 평가에서는 찾을 수 없었던 혁신이었다고 강조했다.
이에 기존 치료제와 동급최초 신약간의 이점에 대한 비교평가가 가능해져 가장 큰 가치를 제공하는 약물의 식별이 가능해 지는 등 추가 혁신을 장려할 수 있는 장이 마련됐다고 진단했다.
연구진은 다만 이같은 혁신적인 변화에도 불구 FDA 우선검토 또는 희귀질환 치료 등 혁신지표는 거의 발견되지 않았다는 점은 아쉬운 대목이라며 치료제가 없는 특정 피부질환 환자를 위한 치료제 개발이 장려될 필요가 있다고 진단했다.



