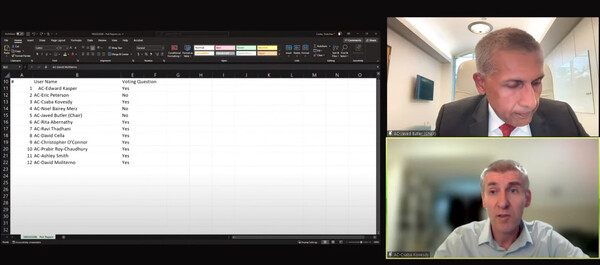
FDA 자문위원회는 앨라일람 파마슈티컬스의 RNAi 치료제 온파트로(성분명 파티시란)의 아밀로이드성 심근병증(ATTR-CM) 추가 적응증 신청에 대해 승인을 권고했다.
자문위는 13일 온파트로에 대해 아밀로이드성 심근병증의 치료이점이 위험을 능가한다고 9:3의 찬반의견으로 승인을 권고하는 투표를 했다. FDA의 승인목표예정일은 10월 8일로 설정됐다.
통상 FDA는 자문위의 의견을 따르는 경향이 있으나 반드시 승인여부 결정방향이 일치 하지 않는다.
온파트로에 대한 자문위의 찬반투표의 결과는 승인에 긍정적이나 질의자체가 이점이 위험을 능가한다는 대목이다.
의장으로 참여한 미시시피대 의대 자베드 버틀러(javed butler) 박사 등 반대의견을 제시한 자문위원들은 이점이 위험보다 높다는 점 보다 기존 치료제인 화이자의 빈다켈과 빈다맥스보다 더 나은 치료제 인지를 고려하면 임상데이터는 부정적이라고 평가했다.
APOLLO-B 임상결과에서 증상의 개선에도 불구 궁극적으로 모든 원인의 사망, 심혈관 사건의 빈도 등에서 위약대비 통계적 유의성을 제시하지 못한 만큼 기존 치료제 대비 이점을 제시했다고 판단하기 어렵다는 취지다.
앞서 FDA는 브리핑 문서와 자문위 논의를 통해 승인에 부정적인 입장을 유지했다는 점에서 승인권고에 해당하는 자문위 찬반투표 결과에도 불구, 승인여부를 예단하기 어려운 상황이다.
온파트로는 트랜스티레틴 가족성 아밀로이드성 다발신경병증(ATTR-FAP)을 적응증으로 2018년 FDA 승인을 받은 이후 이번에 심근병증 적응증에 도전하고 있다.