FDA 자문위원회는 다발성 골수종 5차 치료제인 카빅티의 조기치료요법에 대해 승인을 지지하는 만장일치의 의견을 냈다.
FDA 자문위원회는 15일(현지시간) 존슨앤드존슨의카빅티 관련 다발성 골수종 2차이후 요법에 대한 승인신청건 관련 FDA가 제기한 높은 초기사망률과 부작용 사망률 우려에 대해 무진행생존의 전체 데이터 맥락에서 보면 감내할 수준의 위험이라는 만장일치의 투표결과를 통해, 승인을 권고했다.
존슨앤드존슨은 FDA의 브리핑 문서에 제기된 우려에 대해 표준치료 대비 장기적인 무진행생존 이점을 고려할 때 CAR-T와 관련 이미 잘 이해되고 있는 아나팔락시스 등 투약직후 발생하는 초기 위험수준이라는 점을 강조했다.
이와함께 다발골수종 치료부분 개선의 폭를 고려할 때 최근 10년(2011~20년) 오히려 낮아지고 있다는 점을 제시하며 카빅티의 초기 치료 임상데이터는 환자의 미충족 요구에 더욱 부합한다고 주장했다.
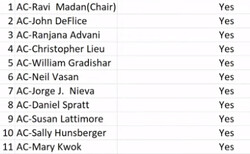
이에 11명의 자문위원은 무진행 생존의 전체 맥락에서 살펴볼 때 초기사망의 위험은 감내할 수준인가 여부를 묻는 투표에서 만장일치로 수용가능한 수준이라고 투표, 승인을 지지했다.
FDA는 CAR-T 관련 승인신청 기반 임상의 치료 라인과 다른 보수적 승인 기조를 보여주고 있다. 카빅티의 경우 유럽에서 MM 4차 요법이나 FDA는 5차 요법으로 승인한 바 있다.
자문위의 권고에 따라 추가적응증 승인 가능성이 높아진 가운데 2차 또는 3차요법까지 어느수준까지 전진배치가 가능한가에 관심이 모아지고 있다. 지난 2월 유럽의약품청 산하 인체의약품위원회는 2차요법으로 승인 권고한 바 있다.



