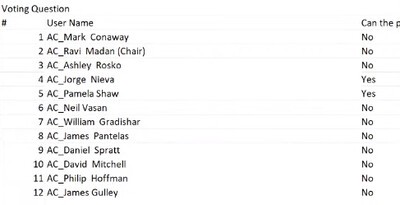
FDA 자문위는 가속승인 상태인 KRAS 표적 비소세포폐암 치료제 루마크라스(소토라십)의 정식승인 전환에 부정적인 권고의견을 냈다.
FDA 종양학 자문위는 5일 정식승인 전환에 대한 확증 3상의 임상 결과 명확성을 갖고 있다고 해석되는 냐는 질의에 2:10의 찬반 투표를 통해, 불명확성을 지적하는 권고의견을 냈다.
이번 논의된 임상은 CodeBreak200 3상(NCT04303780)으로 루마크라스를 대조군 도세탁셀과 비교, 화학요법과 PD-(L)1 면역항암제 이후 KRAS G12C 변이 진행성 비소세포폐암 (NSCLC)에서 무진행 생존 이점을 평가했다.
지난 2월 란셋에 발표된 결과는 중앙값 17.7개월의 추적조사에서 소토라십의 무진행생존기간은 5.6개월로 대조군 4.5개월 대비 개선(HR 0.66/ p=0 ·0017)됐다는 결과를 발표한 바 있다. 부작용 면에서도 도세탁셀 대비 유리한 결과를 제시했다.
그러나 이번 자문위는 임상결과는 소토라십에 우호적인 결과이나 적은 임상참가자 수와 투약중단 등으로 인한 소토라십과 대조군 평가군의 균형에 문제를 제기, 확증임상으로 치료효과의 이점을 명확하게 제시하기에는 부족하다고 평가했다.
FDA는 확증임상이 안전적인 효능을 평가하기 부족하나 1,2차 비세세포폐암 치료환경에서 추가임상이 다양하게 진행되고 있다는 점 등을 고려, 당장 가속승인 철회여부 등에 대해 검토하지 않을 계획이다. 단 추가임상시험 시행 요구 필요성 등에 대해서는 논하지 않았다.
루마크라스는 21는 5월 최초의 KRAS 표적 치료제로 FDA 승인을 받았다. 국내에는 22년 2월 도입됐다.