
최초의 대사이상 관련 지방간염(MASH/이전 비알콜성 지방간염; NASH)치료제가 FDA로 부터 가속승인을 받았다.
FDA는 14일 중등도에서 진행된 2,3기 간섬유화증이 있는 비알콜성 지방간염(NASH) 성인 환자의 치료제로 마드리갈의 레즈디프라(Rezdiffra/레스메티롬)를 승인했다고 발표했다.
FDA 약물평가센터 니콜라이 니콜로프 박사는"간섬유화증이 있는 NASH의 간손상 문제를 직접 해결할 수 있는 약물은 없었다" 며 "레즈디프라의 승인은 이러한 환자에게 식이요법과 운동이외 첫 치료옵션이 될 것" 이라고 설명했다.
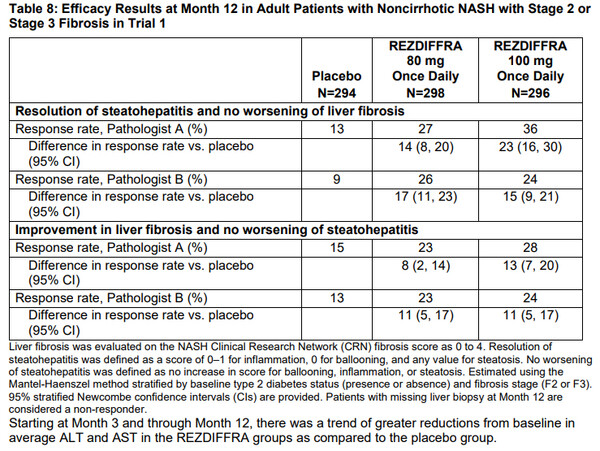
1일 1회 경구용 갑상선 호르몬 수용체(THR)-β 선택적 작용제인 레즈디프라의 승인은 MAESTRO-NASH(NCT05500222) 3상의 중간평가 결과와 2상 분석 데이터를 기반으로 한다. 투약 12개월 후 레즈디프라로 치료받은 피험자 중 위약을 투여받은 피험자에 비해 더 많은 비율에서 NASH가 해결되거나 간 섬유화증의 개선이 이뤄졌다.
레즈디프라 80mg군의 26%~27%, 레즈디프라 100mg의 24%~36%가 NASH 증상이 해소됐으며 간섬유화증의 악화가 완화된 반면 위약군은 9%~13%였다. 투약용량은 환자의 몸무게 100kg기준으로 그 이하는 80, 이상은 100mg군을 복용하게 된다.
흔한 부작용은 설사와 메스꺼움 등이 었으며 간독성 및 담낭관련 부작용과 같은 경고 및 예방조치가 포함돼 승인을 받았다. 또한 스타틴과의 약물상호작용 발생에 대한 주의사항이 포함됐다.
한편 레즈디프라는 임상적인 이점에 대한 합리적 예측 가능성이 있는 대리 및 임상 평가결과를 기반으로 가속승인을 받음에 따라 MAESTRO-NASH 3상의 54주차 결과를 통해 정식승인 여부에 대한 평가를 진행할 예정이다.
레즈디프라 승인으로 FDA 승인신청 도전에도 도달하지 못하고 수많은 후보약물 들이 임상개발 단계에서 철수했던 영역의 실패 역사는 마무리됐다.




