존슨앤드존슨의 이중특이성 항체 탈베이(Talvey, talquetamab-tgvs)가 다발성 골수종 5차 치료제로 FDA 가속승인을 받았다.
존슨앤드존슨은 10일 이전 프로테아좀 억제제, CD38항체 등를 포함 최소 4가지 치료를 받은 재발성 불응성 다발성 골수종 성인환자를 위한 탈베이가 FDA로부터 가속승인을 받았다고 밝혔다.
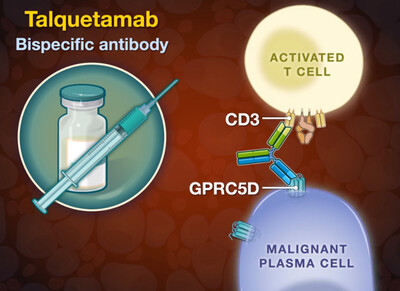
탈베이는 CD3·GPRC5D 표적으로 하는 이중특이성 항체로 GPRC5D항원을 표적으로 하는 동급 최초의 치료제가 됐다.
승인기반 임상은 MonumenTAL-1 1/2상(NCT04634552). 사전 4가지 치료를 받은 187명의 환자중 격주 1회 탈베이를 피하주사한 환자군에서 객관적반응율은 73.6%였다. 이중 완전반응은 58%에 달했으며 나머지도 환자군도 매우 좋은수준의 부분반응(VGPR)을 보였다.
주1회 피하주사(0.4mg/kg)군도 73%의 객관적반응율을 보였으나 완전반응은 35%로 격주투약군보다는 낮았다. 반응지속기간도 격주군에 유리한 결과를 보여 격주 피하주사로 승인됐다.
흔한 부작용은 발열, 사이토카인 방출 증후군, 미각장애, 손발톱 장애, 근골격계의 통증, 피부장애, 발진, 피로, 체중의 감소, 구강건조, 건조증, 삼킴곤란 등이었다.
존슨앤드존슨은 "BCMA 표적 이중특이성항체(테크베일리) 또는 CAR-T 세포 요법(카빅티/아베크마)로 치료를 받은 환자를 포함, 사전에 많은 치료를 받은 환자에서 탈페이는 효능과 안전성을 제시했다 며 "예후가 좋은 않은 질병단계에 첫번째 치료옵션" 이라고 밝혔다.
탈베이는 리브리반트와 테크베일리에 이은 존슨앤드존슨의 세번째 이중항체이자 지난해 승인받은 테그베일리와 동일한 다발성골수종 5차에 포진하게 됐다.
또한 다발성골수종에서 자사의 CAR-T 세포치료제 카빅티와 동일한 포지션을 갖고 있다. 1차 치료제인 다잘렉스를 포함, 막강한 라인업을 확보했다. 다만 제품간의 링겔만 효과를 제거하기 위한 적절한 배치는 숙제로 남게 됐다.
존슨앤드존슨의 언급을 기반으로 보면 탈베이의 포지션은 최종병기에 해당한다.
한편 국내기관도 임상에 참여, 국내허가는 신속한게 진행될 토대는 마련돼 있다.



