내년에 시행되는 임상시험용의약품 최선 안전성 정보보고(ICH DSUR)의 보고범위는 어떻게 될까.
식약처는 30일 DSUR 정책설명회를 통해 관련 민원인 안내서의 주요내용을 설명했다.
DSUR의 도입 배경을 보면 공통된 표준보고서를 제시해 일관성과 효율성을 촉진하고 규제당국이나 이해당사자에게 임상시험약에 대한 안전성 정보를 정기적으로 제공하는데 있다.
임상개발하는 동안 안전성 정보의 주기적 분석은 시험대상자에 대한 위험을 지속 평가를 위해 필요하며 중요한 위해성을 요약해 모니터링 할 대상을 강조하고 임상시험 참여 대상자의 안전성에 대한 보고를 강화하는데 있다.

또 새로운 약물의 안전사항 개요서를 확보 및 평가하고 개별조사연구의 상황, 제조변경 정보, 전체적 개발현황 및 계획을 제공받게 된다.
여기에 정기적 안전성 보고의 내용과 양식, 제출시기의 공통화는 ICH지역들이 동일하고 포괄적인 양질의 보고를 수령하는데 도움이 된다.
그럼 DSUR의 범위는 어떨까. 시험약을 사용한 임상시험 1~3상과 시판된 의약품을 사용해 허가된 적응증내에서 수행하는 4상 임상, 시험약의 치료목적 사용, 의약품의 제조 공정 변경에 따른 동등성을 증명하기 위한 목적으로 수행한 임상시험이 포함된다.
아울러 관찰 연구 및 역학 연구, 비임상 연구, 시험약과 관련된 다른 DSUR, 제조상 또는 미생물학적 변경사항, 최근 문헌에 출판된 연구, 유효성 부족의 결과로 인해 대상자의 안전에 직접적인 영향을 줄 가능성이 있는 임상, 동일 치료계열 제품 관련 안전성 자료, 공동 개발자에 의해 수행된 임상으로 계약에 의해 허용된 경우가 보고 범위이다.
여기서 DSUR과 정기적인 최신 안전성 정보(PSUR)과의 관계는 어떨까.
시판약에 대해 수행되는 임상으로부터 발견된 정보는 DSUR에 포함해야 하나 시판 후 안전성과도 관련이 있으며 PSUR에도 보고돼야 한다.
특히 DSUR과 PSUR간의 내용 중 중복되는 부분이나 반복되는 부분이 있을 것으로 예상되나 두 보고서의 집중하는 주제가 다르고 작성 주기 및 수령자가 다르므로 두 보고 모두 포괄적이고 독립적으로 작성돼야 한다.
DSUR의 연례 정기보고서는 전세계 어느나라에서든 임상을 실시하기 위해 의뢰자가 첫 번째 승인을 받은날이 시작일이며 1년후 첫번째 DSUR를 보고하게 된다. 제출기간은 60일이며 60일이 지난 이후 1년이 지난면 두번째 보고일이 시작된다. 역시 60일내 보고한 후 다시 1년 후 세번째 보고가 이뤄진다.
여기서 DSUR 보고기간은 각 국가나 지역의 법령 및 규정에 명시된 기간동안 계속 제출하며 마지막 DSUR은 해당 국가나 지역에서의 최종 연례보고서임을 기재하고 다른 지역에서의 임싱시험 지속여부에 대해 기재하면 된다.
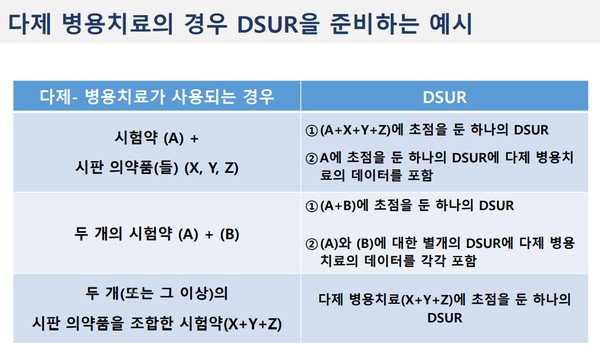
이밖에 병용요법과 관련한 DSUR의 경우 하나의 자료로 보고하면 되며 각 유효성분에 대한 별도의 DSUR은 복합제의 각 유효성분에 대한 임상을 진행하는 경우 제출하면 된다.
단일제제를 병용으로 사용하는 다제 병용의 경우 다제 병용치료에 대한 하나의 DSUR과 하나 또는 그 이상의 개별 성분에 대한 DSUR이 있다. 다제 병용치료 연구의 정보는 하나 또는 모든 성분의 DSUR에 포함된다.
즉, 예를 들어 시험약 A와 시판의약품 X, Y, Z의 경우 A+X+Y+Z에 초점을 둔 하나의 DSUR과, A에 초점을 둔 하나의 DSUR에 다제 병용치료의 데이터를 포함하고 있다.



