아스텔라스, 바우처활용 불구 승인목표예정일 5월 22일로 제설정

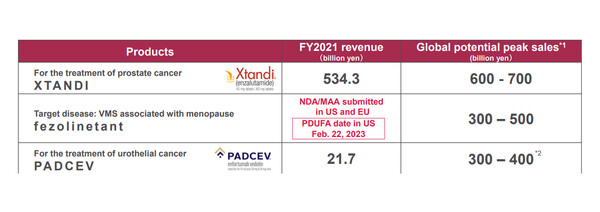
아스텔라스의 폐경 관련 혈관운동증상(VMS) 치료제 페졸리네탄트(Fezolinetant)에 대한 FDA 승인일정이 3개월 연장됐다.
아스텔라스는 우선심사 바우처를 활용 승인목표예정일을 2월 22일로 검토기간을 6개월 앞당긴 폐경 관련 혈관운동증상(VMS) 치료제 페졸리네탄트의 승인일정이 3개월 연장됐다고 19일 밝혔다.
FDA가 재설정한 승인목표예정일은 3개월 연장돼 5월 22일로 재설정됐다. 통상 시장거래가가 1억달러 전후에 달하는 바우처 활용 효과가 대부분 사라지게 됐다.
아스텔라스는 페졸리네탄트의 중등도에서 중증 혈관이상을 경험하는 여성에 잠재적인 이점에 대해 확신하고 있으며 FDA와 이번 승인신청건에 대해 지속적인 협력을 계속하겠다고 밝혔다.
페졸리네탄트는 면홍조와 야간발한증 등 폐경 후 발생하는 혈관운동증상의 개선을 적응증으로 한 비호르몬 화합물인 뉴로퀴닌3(NK3) 수용체 길항제다.
페졸리네탄트는 아스텔라스의 차세대 주력품목으로 연간 최대 판매액을 3000억~5000억엔(한화 3조원 이상)을 기대하고 있는 라인업이다. 이를 위해 우선심사 바우처까지 투자했으나 검토기간이 연장됐다.
저작권자 © 뉴스더보이스헬스케어 무단전재 및 재배포 금지



