평가 시 의학적 권고-임상효과성 병행적 위치
2020년부터 시행되고 있는 약제 급여적정성 재평가는 정부의 설명과는 달리 제약업계에는 살생부로 받아들여지고 있다. 실제 그동안 재평가를 받은 11개 성분 중 3개가 급여제외, 4개는 급여사용 범위 축소로 결론났다. 올해 진행 중인 8개 성분도 상황은 녹록치 않아 보인다.
제약사들이 재평가 대상이 된 자사 제품의 급여를 종전대로 계속 유지하려면 임상적 유용성을 스스로 입증해야 한다. 심사평가원은 이 때 활용할 1·2차 평가지표를 제시했는데, 평가과정에서는 물론 건강보험정책심의위원회에서조차 기준 개선을 요구하자 이번에 '임상적 유용성 항목'과 '사회적 요구도 항목'을 우선 손질했다. 뉴스더보이스는 개선된 두 개 항목을 두번에 걸쳐 자세히 들여다 봤다.<편집자주>

(① 임상적 유용성 항목) 약제 급여적정성 재평가에서 '임상적 유용성 항목'은 급여유지 여부를 판갈음하는 첫 관문이자 최우선적으로 고려되는 평가기준이다. 임상적 유용성이 교과서나 임상문헌 등을 통해 확인되면 종전처럼 급여를 유지할 수 있지만, 유용성이 없는 것으로 평가되면 급여에서 퇴출된다.
따라서 이번 '임상적 유용성 항목' 개선내용은 중요할 수 밖에 없다. 보건복지부와 심사평가원은 '임상적 유용성 항목' 개선의 두 가지 중심축은 '내용의 명확화'와 '합리성 제고'라고 설명했다.
먼저 '내용의 명확화'와 관련해서는 '1차 평가'와 '2차 평가'라는 용어를 각각 '의학적 권고'와 '임상효과성'으로 변경해 평가내용 취지를 구체화했다고 했다. 또 이 두 가지 평가가 단계적 평가가 아닌 병행적 관계인 점을 명확히 했고, '언급' 등의 모호한 표현은 삭제했다고 했다.
'합리성 제고'는 문헌의 질적 수준과 관련된 내용이다. 현재는 효과를 인정한 문헌 비율이 중요하게 고려되는데 이 외에도 문헌의 질적 수준을 종합적으로 고려하도록 했다는 게 심사평가원 측의 설명이다. 구체적으로는 "의학적 권고를 인정한 문헌 개수가 다수가 아니더라도 자료의 질적 수준이 높고, 추천정도가 높다면 충분으로 평가할 수 있다"고 했다.
심사평가원은 이를 토대로 임상적 유용성 판단기준을 경우의 수를 조합해 조견표로 정리해 건정심에 보고했다.
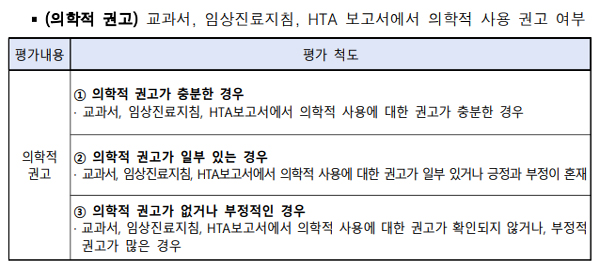
의학적 권고=교과서, 임상진료지침, HTA 보고서에서 의학적 사용을 권고하고 있는 지 확인하는 평가기준이다.
권고 수준은 '충분', '일부', '없음'으로 나눴다. '충분'은 교과서, 임상진료지침, HTA보고서에서 의학적 사용에 대한 권고가 충분한 경우을 의미한다. '일부'는 권고가 일부 있거나 긍정과 부정이 혼재한 경우다. 권고가 확인되지 않거나 부정적인 권고가 많으면 '없음'으로 평가된다.

임상적 효과성=일정수준 이상(SCIE등재 RCT)의 임상연구문헌에서 임상효과성이 확인됐는지 평가하는 기준이다. 평가척도는 역시 '충분', '일부', '없음' 3개로 구분된다. 임상문헌에서 임상효과성 여부를 임상지표로 충분히 입증했고, 긍정적 결과가 다수이면 '충분'에 해당한다.
또 일부 입증 & 긍정과 부정 혼재는 '일부', 입증실패 & 부정적 결과 다수는 '없음'이 된다.
이와 관련 심사평가원은 "의학적 권고와 임상효과성에서 모두 '일부' 이상으로 평가돼야 임상적 유용성 있음으로 판단한다"고 했다.
그런데 실제 조견표 상으로는 의학적 권고와 임상효과성 둘 다 '일부'로 평가되면 임상적 유용성 판단범주는 '불분명'이라고 돼 있다. 다시 말해 두 개 평가기준 모두 '일부' 이상이면서 적어도 하나는 '충분'으로 평가돼야 깔끔하게 임상적 유용성 있음 범주에 들어간다는 의미다.
이와 달리 의학적 권고와 임상효과성에서 각각 '일부'로 평가됐어도 다른 기준이 '없음'으로 평가되면 유용성 판단 범주는 '없음'에 위치한다. 퇴출대상인 것이다.

복지부는 개선된 '임상적 유용성 항목' 기준을 현재 진행 중인 2023년도 재평가에도 활용한다고 설명했다.
한편 재평가 때 활용되는 문헌은 무작위배정 임상시험(RCT)이거나 RCT 대상 체계적문헌고찰 논문이면서 SCIE 등재 학술지에 게재된 논문이어야 한다. 단 희귀질환 약제 등 RCT 수행이 명백하게 어렵다고 판단되는 경우, 예외적으로 선택 문헌 범주를 넓힐 수 있도록 했다.
배제기준은 동물실험(non-human) 및 전임상시험(pre-clinical studies), 원저(original article)가 아닌 연구, 한국어 및 영어로 출판되지 않은 연구, 논문 초록(abstract)만 발표된 연구 또는 증례보고·회색문헌, 중복문헌 등이다.
심사평가원은 'Web of Science Master Journal List (https://mjl.clarivate.com)'를 문헌 확인경로로 제시했다.



