신속보고대상 등 조치 배경, 국내 계획 자료제출 해야
의약품 안전성 정보를 보고할 때 처음 알게 된 시점에서 신속보고 대상이 아니었으나 추가정보에 의해 신속정보 대상이 된 경우 어떻게 해야할까.
식약처는 최근 의약품 안전성정보 보고처리 절차 민원 안내를 통해 이같은 사례의 절차를 설명했다.
만약 추가정보로 신속보고 대상이 된 경우 추가(변경된) 정보를 알게 된 점을 'Day 0'으로 하면 된다. 추가정보를 알게된 날이 0일이 되는 셈이다.
신속보고의 경우 외국정보에서 판매중지나 회수 또는 이에 준하는 조치(사망사례에 대한 조치 포함)를 하는 경우 해당 정보를 알게 된 날로부터 3일 이내에 보고해야 된다. 국내 조치계획은 7일 이내 보고할 수 있다.
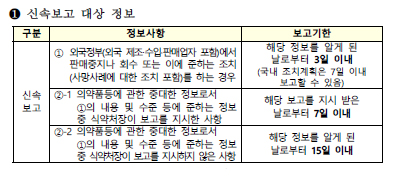
또 의약품등에 관한 중대한 정보로서 외국정부 판매중지나 회수, 사망사례 등의 내용 및 수준 등에 준하는 정보 중 식약처장이 보고를 지시한 사항은 해당 보고를 지시 받은 날로부터 7일 이내에 보고해야 된다.
여기에 의약품등에 관한 중대한 정보로서 외국정부 판매중지나 회수, 사망사례 등의 내용 및 수준 등에 준하는 정보 중 식약처장이 보고를 지시하지 않은 사항의 경우 해당 정보를 알게 된 날로부터 15일 이내 보고하면 된다.
반면 신속보고 대상이 아닌 정보는 규정에 보고기한이 명시되어 있지 않으나 해당 정보를 알게 된 분기내 복고를 권장했다.
한편 신속보고 대상은 조치의 배경과 내용, 특징은 물론 근거자료 등 국내 조치계획을 제출해야 한다.
신속보고 대상 이외의 경우 안전성 정보내용(배경, 분석-평가 결과, 근거자료)과 국외 허가사항 및 조치현황, 국내 조치계획(근거자료, 필요시 허가사항 변경 포함)을 내야 한다.
여기서 국외 허가사항 및 조치현황의 경우 식약처 고시 '의약품의 품목허가-신고-심사 규정'에 따라 해당 8개국가, 원개발국, 정보발생국의 내용을 제출해야 한다.
원개발국 또는 정보발생국이 8개국 이외인 경우 품목허가사항을 확인할 수 있는 웹사이트 주소 등을 함께 표시하고 원칙적으로 국문으로 작성하되 내용의 이해를 돕기 위해 특정 문자, 단어, 구-절 등은 원문-국문을 병기하거나 원문을 첨부해야 한다.



