자문위원회 9:1 승인신청 지지...미충족 요구 충족 기대

국내에서 생산되는 흔하지 않은 글로벌제약사 신약의 하나인 렉설티(브렉스피프라졸)의 알츠하이머 초조증상 치료 적응증에 대한 FDA 승인 가능성이 높아졌다.
FDA 정신약물 및 말초·중추신경계 합동 자문위원회는 14일 회의를 갖고 알츠하이머 환자들의 안절부절 하지 못하거나 공격성향을 보이는 초조증 개선을 적응증으로 승인신청한 오츠카와 룬드벡의 렉설티에 대해 9:1의 찬반 투표를 통해 승인을 권고했다.
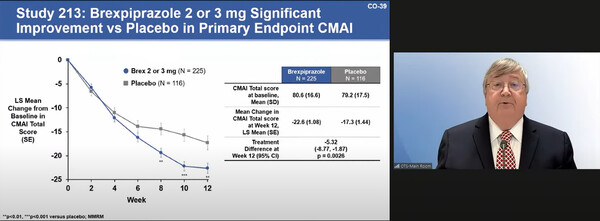
렉설티는 331-14-213(NCT03548584) 3상에서 용량을 증량해 최종적으로 렉설티 2 또는 3mg 투약군은 12주차에 1차 평가변수인 초초함 척도(CMAI/Cohen Mansfield Agitation Inventory)에서 위약군 대비 5.32점 더 개선하는 결과를 제시했다.
개선 점수는 22.5점대 17.3점이다. 투약 용량에 따른 개선 차이는 크지 않았다.
2차 평가변수인 임상 총괄평가-심각도(CGI-S/Clinical Global Impression-. Severity)에서도 위약 대비 -0.27 더 낮췄다. 임상 세부데이터는 이번 자문위를 통해 첫 공개됐다.
자문위는 렉셀티 환자군에서 사망환자가 다수 보고됐다는 우려사항이었으나 미충족 요구를 충족할 수 있다는 점에서 승인에 긍정적인 입장을 견지했다.
렉설티는 2015년 조현병 및 주요 우울장애 보조치료제로 FDA 승인을 받은 후 16년 조현병 유지치료제로 적응증을 확대한 바 있다. 국내에서는 18년 수출용으로 승인을 받아, 국내 제조되고 있다.
저작권자 © 뉴스더보이스헬스케어 무단전재 및 재배포 금지



