
의약품 등의 임상시험계획을 식약처에 신청하기 전에 먼저 확인해야 할 사항은 무엇일까?
식약처는 22일 임상시험정책설명회를 통해 관련 주요 민원 질의응답을 소개했다.
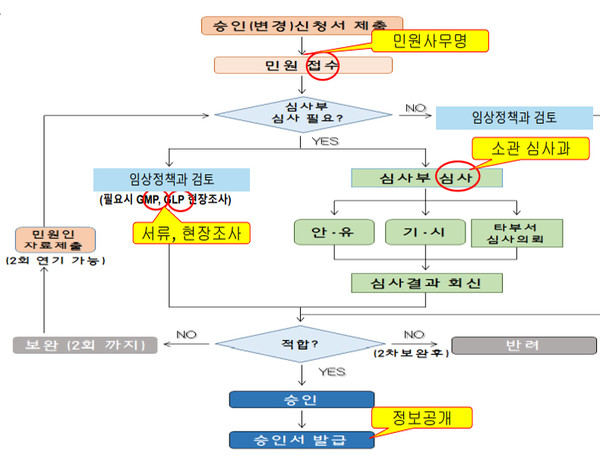
주요내용을 보면 먼저 민원사무명을 제대로 확인해야 한다. 승인, 변경승인, 변경승인-계획서 추가를 구분해야 한다는 것이다.
임상시험계획 변경시 변경하고자 하는 임상시험 일련번호를 정확히 확인이 필요하다는 의미다. 다른 임상시험일련번호 연계시 잘못된 변경으로 진행될 가능성이 있기 때문이다.
아울러 동일한 임상시험용약으로 진행 중인 임상시험이 있는 경우 '임상시험변경승인-계획서 추가'로 제대로 확인하고 민원 신청해야 된다.
또 체크리스트 확인도 꼼꼼하게 해야 한다. 올해 1월부터 주사침 관련 사항이 새롭게 추가됐다. 주사침 포함 여부와 주사침 포함시 미국이나 일본, 영국, 독일, 프랑스 등 5개국 해외규제당국의 임상승인 여부 등을 기재하면 된다.
역시 올해 1월 추가된 GMP 관련해 제조원 GMP검토 이력, GMP실태조사 필요시 GMP 관련 서류 제출여부 기재도 해야 한다.
아울러 체크리스트에서 비OECD 국가의 비임상시험 자료 포함여부도 작성해야 한다.
임상시험계획 변경보고 시 확인사항도 있다.
임상시험계획 변경보고 대상 중에서 실시기관 또는 임상시험검체분석기관의 변경, 시험책임자 변경, 시험군 또는 대조군 추가, 임상시험 종료 및 조기중단 기준 변경, 임상시험대상자 투약방법 및 투약기관 변경, 시험약에 대한 안전성-유효성 평가방법 변경 등을 살펴야 한다.
변경보고 적용 시점은 보고내용 제출 신청 완료 후 식약처 접수 확인 완료시부터 변경사항 적용이 가능하다.
변경보고 전에 IRB 심의가 필요한지 다기관 시험의 경우 모든 실시기관의 승인서 제출이 필요한지, 변경보호 후 바로 보고사항을 반영한 임상시험 진행이 가능한지, 시험대상자 동의서 변경 등을 자세히 체크해야 한다.
임상시험 계획 변경 승인이 불필요한 사항은 임상시험 결과 업데이트나 임상시험 승인시 시정사항 반영하기 위한 변경, 배치 정보 업데이트, 단순 오기 정정, 실제 제조품질관리 변경 없이 문서상 편집 등 표기 변경의 경우이다.
한편 임상약의 품질 변경자료 일괄적용 대상 및 절차와 관련, 동일한 임상약으로 다수의 임상 진행하는 임상약의 품질변경사항을 동일 임상시험번호 내의 다른 계획서까지 일괄적용이 가능하다.
아울러 유전독성불순물 등 품질심사 제출자료의 대상은 허가된 의약품에서 불순물이 검출된 약품 및 해당 성분 함유 제제 임상시험 승인 신청 민원이다. 발사르탄, 니자티딘, 메트포르민, 바레니클린, 로사르탄, 이르베사르탄 등이 대상이며 향후 추가될 수 있다.
이밖에도 멸균주사침 심사자료 등 임상시험에 사용되는 주사침 기재사항은 간소화됐다.
의약품에 포함된 주사침의 심사자료 제출이 다국가 임상시험으로 해외 규제당국인 미국이나 일본, 영국, 독일, 프랑스 등 5개국에서 승인을 받은 경우 이를 증빙하는 서류(승인서 등)과 의료기기 제조원의 품질부서 책임자 또는 그 동급 이상의 책임자가 서명한 문서로 해당 의료기기가 국제 기준규격(ISO 7864 또는 11040-4 등)을 준수해 관리되고 있음을 증명하는 문서를 제출해야 한다.
뿐만 아니라 정보공개 작성시 유의사항을 보면 임상시험 승인 정보 중 공개항목은 전체 공개가 원칙이며 특별한 사정이 있어 부분 공개가 필요한 경우 별도 협의가 필요하다.
임상변경 중 계획서 추가 시 정보공개 항목 작성이 필수이며 기존 내용 수정은 필수적이다. 선정 및 제외기준 항목마다 별도 행으로 기재하며 임상시험 계획서 참고라고 기재는 불가하다.



