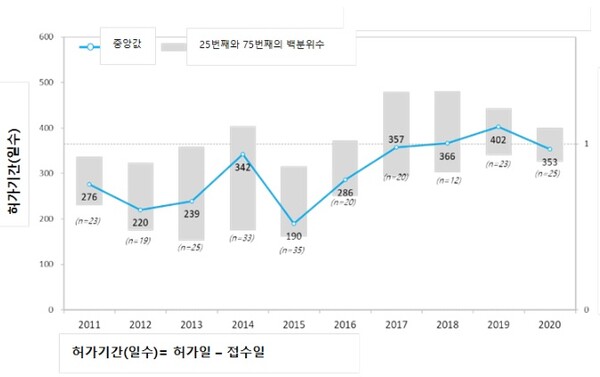
국내에서 신약을 허가 받기 위해 소요되는 기간이 평균 314(313.7일)일이 걸리는 것으로 나타났다.
생물의약품은 화학의약품에 비해 허가기간이 43.2일이 더 소요되는 것으로 나타났다.
희귀의약품의 허가 기간 중앙값은 다른 의약품에 비해 130.4일이 빨랐지만 2016년 이후 증가되는 추이를 보이고 있다.
이 같은 결과는 2011년부터 2020년까지 국내에서 허가를 받은 글로벌제약사의 235개 신약을 대상으로 한국글로벌의약산업협회(이하 KRPIA)가 진행한 ‘한국의 신약 허가 기간에 대한 조사 연구’를 통해 밝혀졌다.
KRPIA는 신약의 허가 기간 지연 배경으로 GMP검토 기간 지연을 꼽았다.
KRPIA는 이와함께 2019년에 발표한 지난 2017년까지의 조사 결과(평균 299.7일)와 비교하면 허가 기간이 2주 정도 늘어난 것이라고 밝혔다.
또 합성의약품(166개, 70.6%)은 291.0일(중앙값), 바이오의약품 (69개, 29.4%)은 353.0일(중앙값)이 걸렸다.
신약 효능군별 비교분석에서는 항암제의 허가 건수가 92건(39.1%)으로 가장 많았고, 효능군간 기간에 대한 차이는 거의 없었다.
전체 신약의 37.4%를 차지하는 희귀의약품은 2020년까지 88개의 품목이 허가됐다. 희귀의약품의 허가까지 기간은 일반 품목에 비해 평균 130.4일이 빨랐다.
KRPIA는 "다만 2016년 이후 희귀의약품의 허가·심사 기간은 증가했다"면서 "희귀의약품의 경우 별도의 희귀의약품 지정 절차가 필요해 이를 포함한 총 민원검토에 소요되는 기간은 더 늘어나게 됐다"고 밝혔다.
KRPIA는 또 "2015년 7월 1일 이후 시행된 희귀의약품에 대한 GMP 심사, 기준 및 시험방법 심사와 함께, 위해성 관리 계획의 도입, 바이오 의약품의 증가 등의 복합적인 원인이 작용한 것으로 확인됐다"고 지연 배경을 설명했다.
KRPIA는 "이번 연구를 통해 허가∙심사 과정 중에 GMP 심사 기간이 평균적으로 안전성∙유효성 심사나 기준 및 시험방법 심사에 비하여 오래 걸리는 것으로 파악됐다"면서 "특히 GMP 현지 실사 여부 및 일정, 이에 따른 심사 기간은 허가심사기간에 큰 영향을 미쳤다"고 분석했다.
다만 코로나19 영향을 받았던 2020년 허가심사 기간은 353일로 2019년 402일에 비해 49일이 단축됐다.
KRPIA는 “지난해 7월 약사법이 개정되면서 우선심사·조건부 허가와 같은 신속허가·심사 제도의 개선을 위한 여러 노력이 있었다"면서 "허가 소요기간 단축을 위해서는 심사 부서의 전문 인력 확충, 관련 규정의 국제조화 및 외국 규제 기관과의 협력 강화, 상호 인증 제도의 확대 등 지속적인 노력이 필요하다"고 밝혔다.



