
동시에 두 개의 다른 항원을 결합한 '이중특이항체' 약물 개발에 다국적제약기업들이 드라이브를 걸고 있어 주목된다.
이중특이항체는 단일클론항체 치료제에 비해 특이적 항원 결합 부위를 추가로 갖추고 있어 내성에서 보다 자유롭고 암세포에 대한 살상효과가 높으며 치료비용이 절감된다는 장점이 있다.
바이오협회와 한국바이오경제연구센터가 발간한 바이오이코노미리포트 '바이오베터 기술개발 동향' 최신호에 따르면, 지난 몇 년 동안 글로벌 이중특이항체 시장은 초기·말기 암 및 고형암과 관련된 다양한 유형의 암에 대한 임상평가가 시도되다 2015년 첫 약물의 승인 이후 2020년까지 121%의 연평균 성장률을 기록하고 있다.
또 시장에서 상업적으로 이용 가능한 이중특이항체의 수는 2028년까지 150% 증가가 예상된다.
현재까지 제품화에 성공한 약물은 6개로 이 중 블린사이토, 헴리브라, 리브레반트, 바비스모 등은 FDA로부터 승인을 받았고 룬수미오와 테크베일리는 EMA에서만 승인을 받았다.
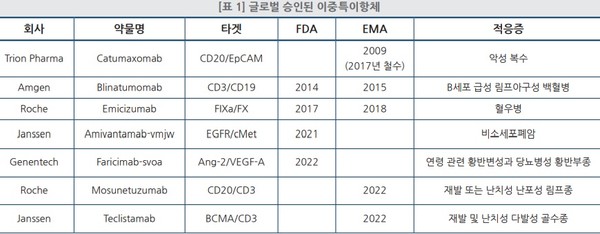
이들 외에 현재 개발을 진행 중인 회사들로는 로슈와 화이자, 애브비와 아케소가 있다.
아케소는 카도릴리맙(Cadonilimab)은 PD-1/CTLA-4 이중특이성 면역치료제 신약이며 세계 최초로 이중면역관문억제제 이중특이항체로 중국에서 지난 6월 시판허가를 받았다.
카도릴리맙은 백금 기반 화학요법 중 또는 후에 재발성/전이성 자궁경부암 환자의 치료를 위한 임상2상 연구에서 객관적 반응률 33.0%, 완전관해 비율 12.0%를 달성했다.
카도릴리맙은 약 8~13개월까지 전체생존을 연장했다. 현재 폐암, 간암, 위암, 자궁경부암, 신장암 등 주요 암 적응증에서 다수의 임상시험을 계획 중이며 국소 진행성 자궁경부암에 대한 임상이 진행 중이다.
또 초기단계의 간세포 암종 및 위 또는 위식도 접합부 암을 치료하기 위한 임상 2상, 3상도 진행하고 있다.
또 다른 이중특이항체 파이프라인 Ivonescimab은 항종양 면역 반응을 자극하고 종양 혈관신생을 억제하는 PD1/VEGF 이중특이항체로, EGFR-TKI 치료 후 EGFR 돌연변이가 있는 국소 진행성 또는 전이성 비편평 비소세포폐암을 치료하기 위해 연구되고 있다.
치료 경험이 없는 PD-L1 양성환자 54명 중 최소 1회의 치료 후 종양 평가를 받은 환자 중 객관적 반응률은 50.0%, 질병 통제율(DCR)은 93%였다.
1차 치료제로 키트루다 단독요법과 비교하는 임상 3상연구를 수행 중이며 이전 EGFR-TKI 요법(NCT05184712)에 실패한 EGFR+ 진행성 비편평 비소세포폐암에서 Ivonescimab + 화학요법 대 화학요법에 대한 3상 연구가 진행 중이다.
로슈의 임상3상에 있는 파이프라인 글로피타맙(Glofitamab)은 B세포 표면의 CD20과 T세포 표면의 CD3을 표적 설계된 이중특이항체로, 재발성 또는 불응성인 혈액암 환자를 대상으로 임상을 진행 중이다.
2상 NP30179 확장 연구에는 사전 치료를 많이 받고 난치성이 높은 미만성 거대 B세포 림프종 환자가 포함되었으며 12개월 이상의 중앙값 추적 조사 결과 환자의 39.4%(n=61/155)가 완전관해를 달성했고, 절반(51.6%; n=80/155)은 객관적 반응률을 달성했다. 글로피타맙과 모수네투주맙을 피하 제형으로 하는 연구가 진행 중이며 올해 FDA를 비롯한 전 세계 보건당국에 허가 신청 작업을 진행 중에 있다.
애브비가 젠맵과 협력을 통해 개발 중인 엡코리타맙(Epcoritamab)은 T세포의 CD3 및 B세포의 CD20에 동시에 결합하고 CD20+ 세포의 T세포 매개 사멸을 유도하도록 설계된 이중특이항체이다.
최근 데이터에 따르면 엡코리타맙 2상 시험에서 이전에 CAR-T세포 요법을 포함한 항림프종 요법의 최소 2개 라인을 받은 환자 157명을 대상으로 한 연구를 진행해 객관적 반응률 63%, 완전관해율 39%를 달성했다. 회사는 연내 EMA 조건부 판매 허가 신청서를 제출한다는 방침이다.
화이자는 다발성골수종치료를 위한 이중특이항체 엘라나타맙(Elranatamab)에 대한 연구를 진행하고 있다. 엘라나타맙은 B세포 성숙 항원(BCMA) CD3 표적 이중특이성 항체로 두 항원에 대한 결합 친화도가 최적화되어 잠재적으로 강력한 T세포를 매개해 항골수종 활성을 이끌어낸다.
엘라나타납의 임상 2상 시험에서 항체-약물 접합체(ADC) 또는 CAR-T 요법으로 치료를 받은 적이 있는 환자 94명을 대상으로 한 임상에서 객관적 반응률은 60.6%를 나타냈다. 이들 중 89.5%는 확인된 진행이나 사망 없이 진행 중이다.
화이자는 엘라나타맙에 대한 1차 평가변수가 올해 말 나올 것으로 예상하고 있다. 이와함께 단독요법과 신규요법을 계획 중에 있다.



