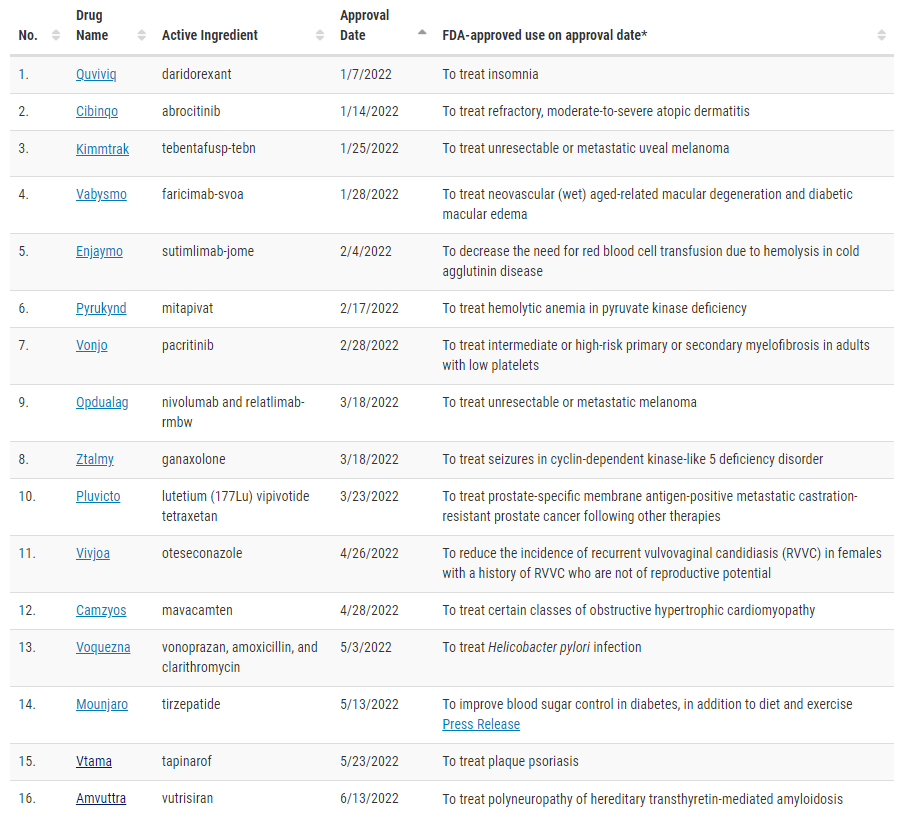
최근 두 달여간 FDA 승인된 신약은 단 한품목도 없었다. 조사누락은 없었고 예상됐던 제약업계의 집단슬럼프가 이어지고 있다.
16일 뉴스더보이스가 FDA 승인내역과 각 제약사의 승인신청 현황에 대해 분석한 결과 지난 6월 13일 아스트라제네카와 앨나일람의 아밀로이드증 치료제 암브트라(부트리시란) 이후 2개월이상의 기간 동안 신약 승인이 아예 없는 기근현상이 지속되고 있다.
지난 7월 뉴스더보이스는 심각한 신약기근 상황에 대해 검토한 바 있다. 다만 발표된 정보를 기반으로 한 분석의 한계가 있는 만큼 조사에서 누락된 부문에 대해 우려했으나 실제 FDA 신약승인이 완전히 중단된 것으로 재확인됐다.
기간을 확장하면 지난 5월 23일 건선 국소도포제 '비타마' 이후 약 3개월 동안 약물평가및연구센터(CDER)가 승인한 약물은 단 1품목이다.
지난해 CDER가 승인한 신약은 50품목으로 분기당 평균 12품목이 넘었다는 점 등을 고려하면 매우 이례적인 현상이다.
또한 최근 2개월간 승인연기된 품목은 노바티스와 베이진의 PD-1 면역항암제 '티스렐리주맙' 단 1품목으로 승인목표일이 잡힌 신약도 적었다.
항암제의 경우 적응증 확대승인만 이어지고 있을 뿐 2분기부터 신약 승인 자체가 없다. 또한 항암제 가속승인의 경우에는 적응증 확대이외 지난해 10월 부터 신약 승인이 아예 중단됐다. (분류상 항암제 알펜리십 성분으로 승인된 과증식 스펙트럼 치료제 비조이즈 제외)
이번 주인 19일 블루버드 바이오의 베타지중해빈혈 유전자치료제 진테그로(베티베글로진 오토템셀)에 대해 승인여부를 결정할 예정이다. 자문위로 부터 만장일치 승인 권고를 받았다.
다만 CDER이 아닌 생물의약품 평가연구 센터(CBER)가 승인 여부를 평가하는 품목으로 CDER의 신약승인은 9월달이 돼야 재개될 전망이다.
다만 변수가 되는 품목은 아미커스 테라퓨틱스의 폼페병 치료제 'AT-GAA'성분 중 미글루스타트다. 승인 목표예정일은 8월 29일이다. 지난 5월 승인일정이 3개월 늦춰졌다.
AT-GAA의 성분은 미글루스트타트와 시파글로코시다제 알파 등으로 병용제제다. 이례적으로 시파글로코시다제 알파는 10월 29일 승인목표예정일을 따로 갖고 있다. 미글루스타트는 고셔병치료제 '자베스카'의 성분으로 아미커스의 주장대로 신약승인 대상인지 신청경로가 확인되지 않았다.
확실하게 신약신청이 진행된 품목은 9월 9일 승인목표일이 집힌 항암화학요법중 호중구 감소증치료제인 스펙트럼사의 롤론티스(eflapegrastim)과 다음날인 10일을 승인목표일이 예정된 BMS의 건선치료제 후보 데우크라바시티닙 등이다.
올해 남은기간동안 승인이 예상되는 신약의 수는 CDER기준 16~20품목 수준으로 승인거부 없이 모두 승인되더라도 올해 신약은 36품목 전후가 될 것으로 전망된다. 2016년 22품목 이래 가장 적은 수준이다.
반면 제네릭은 지난해보다 좀 더 많은 품목의 승인이 예상되고 있다. 10월 회계년도 개시기준 올해 7월까지 731품목이 승인돼 지난해 836품목에 근접했다. 최근 지속적인 제네릭 감소추세가 올해 반전될 것으로 예측된다.
바이오시밀러의 경우 현재까지 최근 루센티스를 참조하는 심멜리를 승인하면서 지난해 수준으로 넘어 4품목이 승인됐다. 휴미라 바이오시밀러 3품목 등 올해 최대 9품목까지 예상되고 있다.
전체적으로 신약을 줄고 제네릭과 바이오시밀러의 승인이 증가하는 변화가 관측됐다.