FDA는 시큐라(Secura)바이오의 PI3K억제제계열 항암제 코픽트라(성분: duvelisib)가 다른 약물에 비해 사망위험이 증가할 수 있다고 경고했다.
FDA는 30일자로 이같은 내용을 담은 안전성서한(FDA Drug Safety Communication) 발송하고 안전성을 계속 평가중으로 코픽트라의 승인존속 여부를 논의할 계획이라고 밝혔다.
코픽트라는 2018년 만성 림프구성 백혈병(CLL)과 소림프구성 림프종(SLL)을 적응증으로 FDA 승인됐다. DUO 3상 무진행생존 이점을 기반으로 승인됐으며 전체생존 이점에 대한 추가자료 제출을 요구받았다.
5년간 추간 분석한 결과에 따르면 중앙값 63개월 추적조사에서 전체생존 HR은 1.09로 대조군보다 사망위험이 높았다. 위험비율도 1.06으로 더 높게 조사됐다.
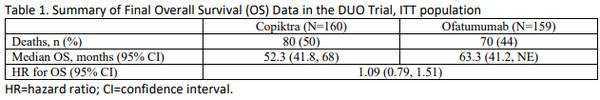
이를 기반으로 FDA는 안전성 서한을 발송하고 의료진과 투약 환자는 위험과 이점을 충분히 고려, 투약토록 당부했다.
한편 앞서 세큐라 바이오는 2018년 당시 CLL과 SLL 이외 가속승인을 받은 여포성 림프종3차 요법에 대해 지난해 12월 가속승인을 자진 철회한 바 있다. 확증임상을 진행하지 않고 자진철회했음 그 사유로 판매에 따른 이익이 없다고 판단했기 때문이라고 설명했다.
PI3K억제제의 시련은 한동안 지속되게 됐다. FDA 자문위원회는 지난 4월 21일 회의를 열어 PI3K억제제의 가속승인 조건을 강화한다는데만 의견을 모으고 논의를 중단한 바 있다.
자문위원회는 회의 직전 핵심주제였던 PI3K 억제제 우코닉 관련 TG테라퓨틱스사가 시장에서 자진철수키로 결정함에 따라 제한적인 논의만 진행했다. 이번 안전성 서한으로 PI3K 억제제에 대한 논의가 다시 확대될 것으로 전망이다.



