FDA로 부터 가속승인 받은 항암제가 시장에 출시된지 1년여만에 퇴출되는 사건이 연이어 발생했다. 퇴출된 항암제는피팩스토와 우코닉이다.
두 품목은 모두 혈액암치료제다. 데칼코마니처럼 퇴출 패턴은 일치한다. 가속승인, 사망위험 경고, 자문위원회 개최 통보, 자문위 전 제약사의 자발적 철회, 자문위 취소다.
세부적으로 단일군 임상 무진행 생존 이점을 보여준 임상 기반 가속승인, 무작위 대조 확증임상서 전체생존에서 대조군 대비 사망위험 증가 안전성 서한 발행 과정도 동일하다.
먼저 지난해 10월 시장에서 철수를 선언한 스웨덴 소제 온코펩타이즈사의 다발성 골수종 치료제 피팩스토(melphalan flufenamide)는 지난해 2월 승인, 7월 안전성서한이 발행됐다.
이어 지난해 10월 28일 FDA자문위원회 개최 3일전 제약사가 시장 철수를 발표하면서 자문위가 취소됐다.
최근인 지난 15일 TG테라퓨틱스사는 PI3K 억제제로 변연부 림프종(MZL)와 여포성 림프종(FL)에 승인된 우코닉에 대한 시장 철수를 발표했다. 피팩스토와 동일하게 21, 22일 양일간 개최될 예정인 자문위을 앞둔 시점에서 이뤄졌다.
만성 림프구성 백혈병과 소림프구성 림프종에 대한 추가적응증 신청도 자진 취하했다.
이에따라 자문위는 21일 하루만 회의를 열어, PI3K 억제제에 대한 가속승인 임상조건을 무작위대조임상으로 강화하는 논의만을 진행 이를 권고키로하고 우코닉의 추가적응증 승인과 품목의 가속승인 유지여부를 논의하는 22일 회의는 취소했다.
승인과 시장철수가 단기간에 이뤄지면서 대외적으로 잘 드어난 피펙스토와 우코닉 사례이외 혈액암치료제 관련 승인과정과 관련된 이슈는 훨씬 더 많다.
피팩스토의 시장철수 선언 이후만 국한해 혈액암치료제로 가속승인 적응증을 자진철회한 품목은 PI3K계열인 자이델릭, 코픽트라 그리고 다발성골수종 치료제 파리닥 등 3품목이 더 있다.
또 신약승인신청 자체를 취하한 파사클리십과 적응증 신청을 취하한 알리코파까지 FDA 승인관련 이슈가 발생한 품목이 지난 6개월간 무려 7개품목에 달한다.
혈액암치료제의 승인철회, 신청철회가 유독 많아진 이유는 일부 논문을 통해 유추할 수 있다.
티모시 올리비에(Timothée Olivier) 제네바 의대교수는 '피팩스토(멜팔란 플루페나미드) 승인과 철회; FDA의 상황에 대한 시사점' 연구 논문을 통해 문제점을 지적했다. 해당 논문은 중계종양학지에 18일자로 실렸다.
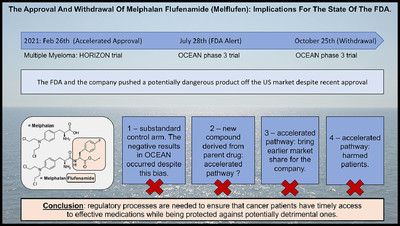
그는 피팩스토가 기존 멜팔란 성분의 유도체 화합물이라는 특성을 고려하지 않은 채 가속승인을 진행한 FDA 결정 등 승인과정의 문제점을 조목조목 지적했다.
이어 가속승인은 즉각 철회토록 유도한 FDA의 후속조치는 칭찬을 받아야 하나 위험한 약물이 승인된 기간동안 누가 혜택을 받았느냐는 문제를 제기했다.
즉 환자는 더 나쁜 전체생존의 위험성에 직면한 동안 제약사는 수익을 발생시킨다는 점에서 가속승인의 불확실성에 대해 근원적인 의문을 제기했다.
이어 컬럼비아대 카리나 스톨스(Carina Storrs) 박사는 '대부분의 혈액암 치료제 임상은 무작위암상이 진행되지 않으며 대리 평가변변수를 사용한다'는 기고문을 통해, 혈액암 임상의 문제를 지적했다.
그녀는 EJC(European Journal of Cancer)에 캘리포니아 및 유타대 연구팀이 지난 2월 발표한 '2015부터 2020년까지 혈액암 임상시험의 특징에 대한 체계적 고찰' 연구논문 등을 기반으로 혈액암 임상연구의 최근 부정적인 흐름을 설명했다.
연구는 최근 5년간 혈액암관련 임상 2609건을 조사했다. 이중 538건(21%)만이 무작위 임상이었다. 또 무작위임상 비율은 2015년 26%에서 2020년 19%로 떨어졌다. 무직위 임상마저 전체생존과 삶의 질을 1차 평가변수로 활용한 비율은 15%에 불과했다.
대부분이 무진행생존과 반응률 등 대리평가변수를 활용했으며 이러한 경향성은 5년간 동일했다. 참고로 고형암 관련 임상의 무작위연구 비율은 연구된 자료를 확인할 수 없었으나 비소세포폐암 등 3개 고형암의 무작위임상 비율은 여전히 절반 이상을 차지하고 있다.
논문의 교신저자 아론 굿맨은 "최근 일부 혈액암에서 단일군 연구가 폭발적으로 증가하고 있다"고 지적했다. 이어 "임상시험의 추세가 분명 잘못된 방향을 향하고 있다"고 덧붙였다.
끝으로 FDA가 단일군 임상이나 대리 평가변수 약물에 대해 엄격한 기준을 정하고 확증임상에서 무작위대조임상을 완료하도록 강력하게 요구할 필요가 있다고 주장했다.
이같은 학계의 우려에 대해 흐름을 함께 하며 FDA 자문위원회는 지난 21일 PI3K 억제제에 대한 임상시험을 무작위 대조 임상을 진행토록 권고키로 했다.
또 가속승인 약물의 확증임상 등이 이뤄지지 않은 경우 자진철회를 유도하는 등 FDA의 규제 움직임이 강화되고 있다.
다만 학계의 우려를 불식시킬 만큼의 충분한 조치가 이뤄지고 있는지는 확신하기 어렵다.
또한 임상조건의 강화가 비용적인 부담으로 작용, 제약사의 개발의욕을 떨어뜨리는 요인이 될 수 있다는 점에 대해 FDA가 지나치게 고려, 승인직후 퇴출이라는 부작용을 유발하고 있음에도 극히 조심스런 행보다.
참고로 지난해 가속승인 건수는 17개 품목 19개 적응증이다. 우코닉과 피팩스토 등 2개 품목 3건의 적응증이 철회됐다. 품목수로나 적응증으로나 10%가 훌쩍 넘는다. 혈액암을 국한하지 않고서라도 실제 부적절한 승인에 따른 부작용은 적은 수준이 아니다.
이번 PI3K 억제제에 대한 임상규제 강화는 분명 진일보한 측면이 있지만 사후약방문식 정책이라는 학계의 의구심을 해소하기에 미흡해 보인다.



