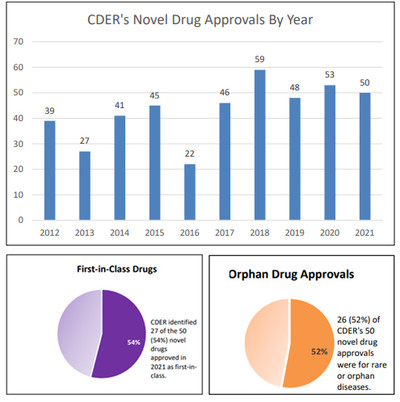
FDA 약품평가연구센터(CDER)가 지난해 승인한 신약은 50품목이다. 생물의약품 평가연구 센터(CBER)에서 별도 승인된 10품목을 포함하면 도합 60품목이 승인됐다.
뉴스더보이스가 약품평가연구센터 자료를 기반으로 지난해 24일 집계한 49품목 대비 1품목이 늘었다. 지난달 27일 레오파마의 IL-13억제제로 아토피피부염을 적응증으로 한 애드브리(Adbry, 투랄로키주맙)이 추가 되면서 50품목으로 늘었다.
FDA가 최근 발표한 2021년 신약 승인보고서에 따르면 FDA CEER 승인 50품목과 CBER승인 10품목 등 60품목의 신약을 승인했다.
CDER 승인 50품목을 먼저 살펴보면 승인품목의 54%인 27품목이 동급최초의 치료제로 승인됐다.
27품목은
애드브리(Adbry/레오파마), 아두헬름(Aduhelm/바이오젠),
베스레미(Besremi/파마에센시아), 브렉사페므( Brexafemme/사이넥시스),
바일바이(Bylvay/알레비오), 코셀라(Cosela/G1 테라퓨틱스),
시탈룩스(Cytalux/온타겟), 엠파벨리(Empaveli/아펠리스),
에브키자(Evkeeza/리제네론 로슈), 케렌디아(Kerendia/바이엘),
코르수바(Korsuva 카라&비포), 렉비오(Leqvio/노바티스),
리브텐시티(Livtencity/다케다), 루마크라스(Lumakras/암젠),
루프키니스(Lupkynis/오리니아), 누리브리(Nulibry 브릿지바이오),
레주락(Rezurock 카드몬-사노피), 리브레반트(Rybrevant/얀센),
사프넬로(Saphnelo/아스트라제네카), 타브네오스(Tavneos/키모센트릭스),
테즈파이어(Tezspire아스트라제네카&암젠), 티브닥(Tivdak/젠맙&씨젠),
버큐보(Verquvo/바이엘), 복즈조고(Voxzogo/바이오마린),
비브가르트(Vyvgart/아르젠엑스), 웰리레그(Welireg/엠에스디),
진론타(Zynlonta/ADC 테라퓨틱스) 등이다.
동급최초 의약품 비율은 2020년 53품목중 21품목(39.6%)에서 27품목으로 비율과 숫자 모두 증가했다.
또 2017년에 15개(33%), 2018년에 19개(32%) 2019년에 20개(42%) 등에 비해 지속적인 증가세를 보였다.
FDA는 이어 50개 승인약물중 76%에 해당하는 38품목은 미국에서 가장 먼저 승인됐다.
희귀의약품은 50개 중 26%(52%)로 절반이상을 차지했다. 2020년 53개 중 31개(58.4%), 2019년 48개 중 21개(43.7%) 등 최근 추이와 유사했다.
패스트트랙과 우선심사 경로 등 가속승인 경로는 활용은 지속적으로 증가했하는 경향을 보였다. 2021년 모두 37품목(74%)라 하나 이상의 가속승인 경로를 통해 승인됐다. 18년 73%, 19년 60%, 20년 68%에 비해 높아지는 추이를 보였다.
패스트트랙의 50품목중 18품목, 획기적 치료제 지정은 14품목 등이었으며 우선심사(Accelerated Approval)경로 활용도 14품목이었다. 특히 우선심사경로 활용의 비율이 크게 높아졌다.
50품목중 49품목에 대한 승인목표예정일 이내 승인을 완료했으며 연기등 별도의 조치없이 승인된 비율은 86%에 달했다.
승인목표일를 맞추지 못한 유일한 품목은 GSK의 PD-1면역항암제 '젬펠리'로 코로나19 영향으로 인한 현지실사지연 등이 이유였다.
한편 CBER에서 승인한 생물학적 제제는 브레얀지(BREYANZI/비엠에스),
아베크마(ABECMA/비엠에스), 라이플라짐(RYPLAZIM/프로메틱),
프리베나20(PREVNAR 20 화이자), 스트라타그래프트(StrataGraft/말린크로트),
백스누반스(VAXNEUVANCE/엠에스디), 티코박(TicoVac/화이자),
코미나티(COMIRNATY/회아자), 레티믹(RETHYMIC),
프레헤브브리오(PREHEVBRIO/VBI백신 ) 등이다.
10품목중 4품목은 코로나19 백신 코미나트 등 화이자 제품이다.
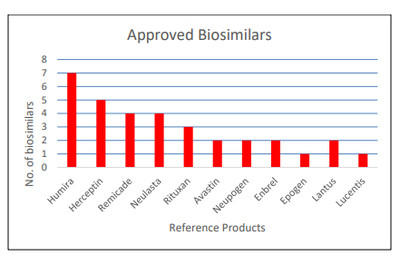
바이오시밀러의 경우 4품목을 승인했다고 밝혔다.
인슐린 글라진의 최초의 교차가능 바이오심인 비아트리스의 셈글리와 12월 승인된 릴리 레즈보글라 등이다.
이외 루센티스를 참조제품으로 한 삼성바이오에피스의 '바이우비즈'와 아달리무맙 바이오심인 코헤누스사의 유심리 등이다.
다만 셈글리의 경우 바이오의약품이 아닌 경로로 승인을 받은 이력으로 인해 시장에서는 신규 제품으로 보지 않는다는 차이점이 있다.
결과적으로 모두 33품목이 FDA 승인을 받았으며 이중 21품목이 시판되고 있다.
이외 아달리무맙 바이오심인 실테조(베링거인겔하임)이 휴미라와 교차가능한 첫번째 바이오심이자 셈글리에 이어 교차 가능 두번째 바이오심으로 승인됐다고 소개했다.




