JAK억제제의 부작용 논란을 마무리하기 위한 실제임상근거(RWE) 기반 임상연구가 올해말 완료된다.
브리검 여성병원은 FDA 승인이 연기되고 있는 JAK억제제관련 토파시티닙과 전체 TNF억제제를 비교, 실제임상근거(RWE)를 기반으로 안전성을 평가하는 2건의 임상을 진행중이다. 해당 임상 결과가 JAK억제제 향후 시장에 가장 큰 영향을 줄 것으로 예상된다.
토파시티닙과 TNF억제제의 안전성을 비교하는 임상은 암과 심혈관질환 등으로 세분화돼 2건의 임상으로 구분, 진행되고 있다. 대상환자는 류마티스 관절염으로 치료받은 환자다.
연구자 프로파일에 따르면 암과 심혈관으로 나뉘어 진행되는 2건의 임상은 각각 2개의 코호트로 구분돼 진행된다.
첫번째 코호트는 IBM마켓스켄(2012-2018), Optum(2012-2020), 메디케어 파트A,B,D( 2012-2017) 등에서 취합된 RWE기반 토파시티닙 또는 TNF억제제 투약군으로 분석대상은 약 10만명이다.
다음 코호트는 JAK억제제 부작용 이슈의 시작점인 토파시티닙과 TNF억제제 아달리무맙 또는 에타너셉의 안전성을 비교한 'ORAL Surveillance'에 대한 임상데이터 복제(RCT-Duplicate) 군이다.
즉 ORAL Surveillance 4상 임상 결과에 대해 세분화해 재분석하고 전체연령(18~65세)에 대한 실제임상근거를 기반으로 JAK억제제의 안전성을 평가한다는 계획이다.
환자는 최소 1년이상 토파시니팁과 TNF억제제 투약군이며 2건의 임상 1차 평가변수는 암 안전성 임상은 고형암과 혈액암 및 비흑색종 피부암 등 각종암에 대한 암의 위험이다. 또 심혈군 임상은 과 심근경색과 뇌졸증 등 심혈관계 부작용 발생비율이다.
이번 임상은 'ORAL Surveillance'가 하나 이상의 심혈관질환이 있는 50세 이상 류마티스 환자를 대상으로 한 제한적인 연구였다는 점에서 전체 환자의 위험에 대한 추가적인 평가가 이뤄지는 것으로 풀이된다.
ORAL Surveillance 임상 결과와 FDA 안전성 서한
지난 9월 FDA는 '안전성 서한'(Drug Safety Communication)을 통해 젤잔즈, 린버크, 올루미언트 등 3개 품목에 대해 일명 블랙박스 경고문구를 추가토록 했다.
FDA는 심장관련 위험성을 추가토록 한 조치와 함께 추가적 안전성 정보를 확보할 경우 보강된 조치를 진행할 계획임을 발표한 바 있다.
즉 9월 안전성 서한은 토파시티닙의 안전성을 살핀 'ORAL Surveillance' 4상을 기반으로 한 선제적 조치다. 그 근거가 되는 세부적 데이터는 다음과 같다.
실제 연구기간은 2014년 3월 14일부터 2020년 7월 22일까지 진행됐으며 1일 2회 토파시티닙 5mg, 10mg군 등 2개 코호트와 아달리무맙40mg 격주 또는 에타너셉트 50mg 주1회 투약 코호트간의 안전성 분석이다.
등록 환자는 4372명, 이중 10명이 제외된 4362명이 분석됐다. 최소 1회 이상 최대 72주간 투약 받은 환자가 대상이다. 등록 기준은 50세 이상 류마티스 관절염환자로 1건이상의 심혈관 질환환자다. 참가자중 여성의 비율이 78.2%로 높았다.
ORAL Surveillance 요약 (정리 뉴스더보이스)
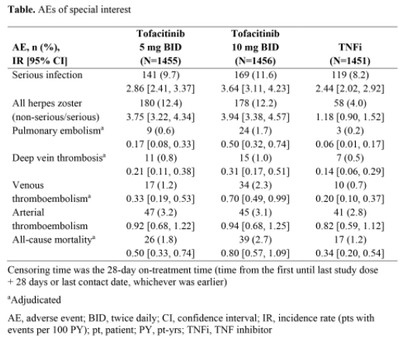
1차 평가(N: 5mg 1455 / 10mg 1456 / TNFi 1451)
비흑색종 제외 종양발생: HR 1.48 (TNF 대비 비열등성 기준 1.8보다 낮음)
주요심혈관계 이상반응: HR 1.33 (비열등성 기준 1.8보다 낮음)
2차 평가
비치명적 뇌졸증 발병률: 5mg 0.27% 10mg 0.33% TNFi 0.34
비치명적 심근경색 발병률: 각각 0.37/0.33/0.16
결핵포함 기회감염 발병률: 각각 0.76/0.91/0.42
간질환 관련 사건의 발생률: 각각 0.90/1.51/0.70
심혈관 이상반응외 심혈관계 사건: 1.21/1/45/1.05
심혈관 긴급이상반응 또는 심각한 이상반응
-긴급 AE: 각각 1333명(91.6%)/1334명(92.3%)/1308명(90.1%)
-심각한 AE: 각각 373명(25.6%)/420명(28.8%)/339명(23.4%)
모든원인의 의한 사망의 발생률(감염, 심혈관, 종양, 기타원인 포함)
5mg 0.50 / 10mg 0.80 / TNFi 0.34
이외 대상포진과 혈액학, 소변검사 등 비정상적 매개변수, 투약 영구적 또는 일시중단 비율 등이 평가됐다.
치료효과는 JAK억제제의 특성상 초기에 빠른 반응이 있었으나 24주차를 시작으로 72주차까지 TNF와 차이가 없었다. 또한 토파시티닙 5mg와 10mg간의 치료효과 차이도 시간이 경과할 수록 사라졌다.
임상연구의 원데이터 분석만으로 한계가 있지만 JAK억제제 관련 FDA의 안전성서한을 통해 진행한 블랙박스 내용 확대라는 선제적 조치는 토파시티닙이 전체적으로 비열등성 기준을 충족했음에도 불구 모든 윈인 중 심혈관 사망비율 등과 연관된 것으로 해석된다.
세부적으로 심혈관사건의 사망률은 TNFi와 토파시티닙 5mg에서 각각 0.20%, 2.25%인 반면 10mg군에서는 0.41%(신뢰구간 0.25 ~ 0.63)로 두배 이상의 차이를 보이는 등 고용량군에서 일부 높은 부작용 수치를 보여주고 있다
JAK억제제 부작용 '65세 이상 및 흡연' 연관 힌트
ORAL Surveillance 임상 사후 분석 결과는 지난11월 7일 ACR 컨버전스 2021에서 포스터 발표로 공개됐다. 다만 그 내용이 매우 제한적이다.
연구진은 FDA로부터 위임 받아 평가를 진행했음을 밝히면서 앞서 살핀대로 TNFi억제제 대비 토파시티닙이 HR 기준점 1.8이하의 안정성을 보여 비열등성을 확인했다고 밝혔다.
토파시티닙 10mg군도 5mg군 대비 HR기준점 2.0이하로 안전한 것으로 판단했다.
사후분석을 통해 새롭게 제시된 내용은 토파시티닙의 부작용이 65세 이상 또는 흡연과 연관돼 있다는 것.
이상반응중 65세 이상에서 심혈관질환 사건(MACE)은 84%, 악성종양은 83.6%가 발생했으며 흡연 경험 환자에서 MACE는 78.4%, 종양은 78.6%가 발생, JAK억제제의 부작용이 65세 이상 또는 흡연과 연관성이 높다고 결론내렸다.
고용량 JAK억제제에 대한 효과의 의문점
JAK억제제 중 토파시티닙을 제외하고 장기임상 데이터가 성숙하지 않은 가운데 이번 안전성 연구에서 살펴볼 대목은 JAK억제제의 저용량과 고용량 효과가 장기투약될수록 차이가 사라진다는 점이다.
애써 임상 연구진은 언급을 피하고 있지만 토파시티닙 5mg와 10mg간의 장기투약에 따른 효과는 류마티스관절염 환자군에서 전혀 차이가 없었다.
JAK억제제의 빠른 초기반응이라는 장점 불구 이를 희석하는 단점으로 장기투약시 TNFi억제제와 효과의 차이가 없어진다는 점 이외, 함께 주목해 볼만한 포인트다.
질병 활성도 28(Disease Activity Score 28)는 첫 평가된 투약 2개월차 5mg는 -2.00점, 10mg는 -2.14점, TNFi는 -1.89점으로 차이를 보인다. 하지만 42개월 차부터는 3개군에서 차이가 완전히 사라진다. 이후 마지막 분석인 63개월는 각각 -3.07, -2.99, -3.05로 토파시티닙 10mg 가장 낮다.
임상적 이점과 통계적 유의성이 확인되지 않는 시점은 투약 3년 전후로 고용량 장기투약의 이점은 향후 추가적인 연구가 필요한 부분으로 해석된다.
다른 여타의 JAK억제제의 경우도 저용량과 고용량에 있어 효과의 차이가 크지 않게 해석되는 다수의 임상 결과들과 비교할 때 그 경향성과 흐름이 유사해 보인다.
심혈관 및 암 부작용 이슈의 정리 시점 전망
미국의 투자자 중심의 분석가들의 전망과 달리 FDA는 좀 더 신중한 모습을 보이고 있다. 업계와 분석가들은 10월부터 연기되고 있던 JAK억제제 승인이 이뤄질 것으로 전망했지만 현재까지도 FDA는 추가적 승인을 미룬 채 세밀하게 들여다보고 있다.
뉴스더보이스가 앞서 살핀대로 부작용 이슈를 정돈하는 과정에 있는 FDA는 크림제형의 JAK억제제를 승인하면서 경구용 블랙박스 경고를 삽입하는 등 어수선한 분위기를 연출하면서도 매우 신중하게 JAK억제제의 부작용 이슈를 살피고 있는 것으로 해석된다.
통상 연구자 임상과 달리 FDA와 연관성을 확인시켜주는 독특한 설계를 갖고 있는 2건의 임상은 올해 내 종료된다. 그 결과를 검토 후 FDA도 JAK억제제에 대한 부작용 이슈를 마무리하는 수순을 밟을 것으로 전망된다.
현재까지 제시된 유일한 힌트인 ORAL Surveillance 임상 사후 분석 결과만 놓고 보면 부정적으로 보이지는 않는다. 실제 진료현장에서 젊은 환자에 대한 투약에 긍정적이었다는 점과도 괘를 함께 한다.
업계의 기대도 정리되지 않은 블랙박스에 연령 또는 금기환자 등 구체적인 정보들이 채워지면서 연기된 적응증 승인과 신약 승인의 과정이 이뤄질 것으로 전망하고 있다. 다만 업계의 바람대로 부작용 이슈가 정리가 될지 또는 다른 변수가 숨어있는지 예단은 쉽지 않은 상황이다.
한편 브리검 여성병원에서 진행하는 RWE기반 임상연구는 한국계 연구진이 수석연구원 및 분석원으로 참여, 실질적으로 연구를 주도하고 있는 것으로 파악됐다.



