이미 등록된 원료의약품과 동일 성분-제조원의 원료의약품을 등록(후발등록품목)하려면 어떤 자료가 필요할까.
식약처가 최근 제약사들이 허가 관련 자주 묻는 질의를 모은 '완제약 중심 허가심사 운영관리 방안 관련 질의응답집'을 공유했다. 이같은 내용은 11일 의약품 허가업무 설명회에서도 언급됐다.
먼저 최초등록품목과 동일 성분-제조원의 원료약으로 후발 등록품목으로 등록하기 위해서는 자료공유 허여서(DMF)를 제출(허여품목)하거나, 요건에 맞는 자료를 별도로 제출(자료제출 품목)하여 등록할 수 있다.
여기서 자료공유 허여서(DMF)는 최초 등록품목의 등록자료를 공유하기 위해 원 제조원 또는 국내 최초 신청인이 발급해주는 것을 의미하며 이 경우 최초 등록인 또는 원 제조원이 자료공유 허여서(DMF)를 통해 허여할 수 있는 자료는 최초 등록품목의 자료에 한한다.
다만 자료제출 품목의 등록자료 허여는 불가하다.
또 허여품목의 등록자료는 최초 등록품목의 자료와 동일한 것으로 간주되며, 이후 등록 자료에 변경이 있는 경우에 자료공유 허여서(DMF)를 제출해 최초 등록품목과 동일한 내용으로 변경등록(보고)해야 한다. 여기서 허여품목의 경우에도 개별 변경등록(보고)이 필요하다.
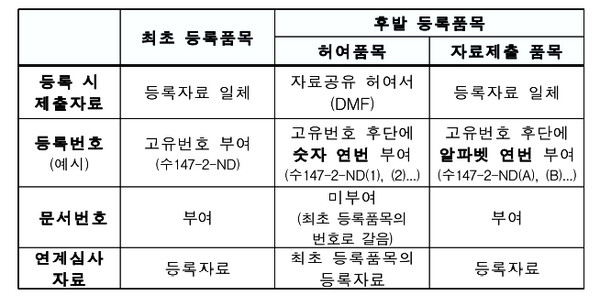
아울러 허여품목으로 등록했더라도 최초 등록품목과 별도로 변경등록(보고)하려는 경우에는 등록자료 일체를 제출해 자료제출 품목으로 변경등록이 가능하다. 이 경우 등록번호는 숫자 연번에서 알파벳 연번으로 변경해 부여하게 된다.
또 DMF 등록자료 변경 이력을 위한 문서번호 설정의 경우 해당 (변경)등록 처리시 문서번호가 부여되며 DMF 신청업체가 요청하는 경우 해당 업체의 문서번호를 병기할 수 있다.
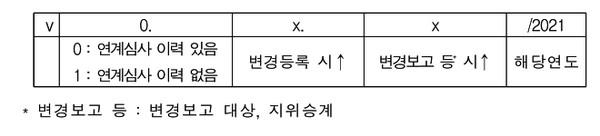
문서번호 부여법은 최초 등록 시 'v0.0.0/처리년도(필요시 제조사 번호기재)'으로 부여하며 단, '21.2.18. 이전에 품질심사를 받고 DMF 등록이 완료된 경우 등에는 v1.0.0으로 부여하게 된다. 완제의약품 연계심사 완료 시 v1.0.0/처리년도(필요시 제조사 번호기재)로 부여하게 된다.
한편 기 등록돼 공고된 원료의약품을 완제의약품 제조업자가 자신이 제조하는 완제의약품의 원료로 사용하기 위해 직접 수입하는 경우, 별도의 등록이 반드시 필요하지는 않는다.
'의약품의 품목허가·신고·심사 규정'이나 '한약(생약)제제 등의 품목허가·신고에 관한 규정'에 따라 완제의약품 품목허가 신청 시 원료의약품 등록자 또는 제조자의 '자료이용 허여서'를 제출하면 된다.
여기서 자료이용 허여서는 원료의약품에 관한 자료를 첨부해 의약품의 품목허가를 신청하거나 품목신고 하는 경우 중 약사법에 따라 그 원료의약품에 관한 자료가 이미 등록된 때에는 해당 원료의약품 등록자 또는 원료의약품 제조자의 자료이용 허여서로 원료의약품에 관한 자료를 갈음할 수 있다.
완제약 변경허가가 진행될때마다 원료약에 대한 연계심사가 진행되는가에 대해 질문에는, 완제약 품질에 영향이 있는 경우 연계심사가 진행되며 완제약 변경 허가사항에 원료약에 대한 변경사항이 미포함시 진행되지 않는다.
신규 완제약 품목허가신청 또는 신고한 경우나 원료약에 대한 변경으로 인해 완제약의 허가사항이 변경되는 경우가 대상이다. 주성분 제조원 추가나 변경하는 경우나 기 허가된 주성분에 대해 21년 2월18일 이후 등록된 원료약 공고번호를 기재하는 경우, 주성분의 규격을 변경하는 경우에 연계심사를 하게 된다. 단 공정서를 전문 또는 일반 공정서를 변경하는 경우나 별규에서 일반 공정서로 변경하는 경우는 제외된다.
연계심사 제외의 경우는 현재 등록된 DMF문서번호의 자료에 대해 연계심사 이력이 있는 경우나 국제공통기술문서(CTD) 비대상인 품목, 제조판매 품목허가를 받거나 품목신고를 한 자의 제조소(수탁처)에 해당 품목과 모든 공정을 동일하게 제조하도록 위탁하는 품목에 대해 수탁처 품목과 동일하게 (변경)허가를 신청하는 경우, 2020년 6월 4일 이후 신청된 의약품 등 사전검토의 결과 통지서를 첨부해 변경 신청한 경우는 제외된다. 다만 심사 완료 후 등록사항에 변경이 발생한 경우는 연계심사를 받아야 한다.
이와함께 기 허가된 주성분 제조원에 대해 원료약 공고번호만을 기재하는 경우 연계심사를 미실시한다. 2021년 2월18일 이전에 심사를 완료해 등록된 원료약 공고번호만을 추가하는 경우이며 다만 심사 완료 후 등록사항에 변경이 발생한 경우는 연계심사를 해야 된다.
이밖에 '원료약 등록에 관한 규정' 별표1 209번의 원료약에 대해 2021년 2월18일 이전에 허가된 주성분 제조원의 정보에 공고번호만을 추가하는 경우, 동일한 공고번호의 허여번호(숫자 연번에 한함)만 변경하려는 경우도 연계심사에서 제외된다.
식약처는 현재 CTD 자료 일부를 제조방법으로 관리하는 것을 주요내용으로 '의약품의 품목허가·신고·심사 규정' 개정을 추진하고 있으며 이 경우 연계심사 대상 민원의 범위가 확대될 것으로 판단하고 있다. 이 사항에 대하여는 향후 '허가 후 제조방법 변경 관리 가이드라인' 등을 통해 안내할 예정이다.



