생물학적으로 제조된 펩타이드를 화학적으로 합성한 의약품으로 개발한다?
식약처가 최근 국내외 제약업계가 주목하고 있는 해당 의약품 개발에 있어 허가방안을 마련했다.
이번 허가방안은 저분자 합성 펩타이드에 관한 것으로 기허가 생물약의 유효성분과 동일하고 불순물의 유형 및 양이 안전한 수준임을 입증하는 국제조화 수준의 자료를 제출할 경우 허가 받을 수 있다.
대상은 국내 허가된 아미노산 40개 이하의 유전자재조합 펩타이드를 화학적 합성법으로 제조한 의약품으로 리라글루타이드, 테리파라타이드, 테두글루타이드 등의 유전자재조합 펩타이드이다.
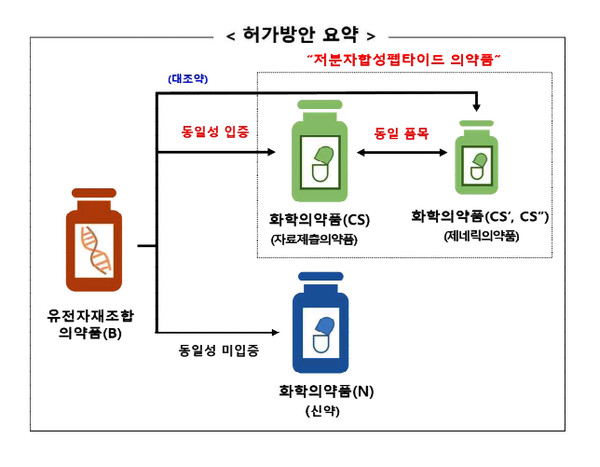
기존 동일한 입증과 관계없이 신약에 준하는 자료를 제출했야 했으나 앞으로는 동일성이 입증되는 경우 동일성 및 불순물 평가자료만을 허가가 이뤄질 전망이다.
여기서 동일성 평가는 1차 구조 및 물리화학적 특성과 2차 구조, 중합체와 응집 상태, 임상 PK-PD나 비임상 등 생물학적 특성을 보게 된다.
불순물 평가는 생물약에도 존재하는 불순물인 경우 그 각각은 생물약보다 작거나 같아야 하며 새로운 불순물은 원료의 0.5% 이하이며 각 불순물에 대한 1차 구조 및 특성 이외, 면역원성 평가를 포함한 주성분의 안전성-유효성에 영향을 미치지 않음을 입증하게 된다.
동일성이 입증되지 않은 경우 신약(N)으로 분류, 동일성이 입증되는 경우 저분자합성펩타이드로 자료제출의약품 분류된다. 동일성 입증자료, 불순물 평가자료, 시설과 품질자료 등 기타로 판가늠한다.
이후 화학의약품의 경우 제네릭으로 분류하나 최초 화학의약과 동일한 수준으로 평가해 허가를 하게 된다. 최초 화학약이 아닌 유전자재조합의약품과 동일성 입증하게 된다.
식약처는 향후 의약품의 품목허가-신고-심사 규정 규정 개정을 추진할 계획이며 규정개정 시까지 이번 허가관리 방안을 우선 적용해 민원처리할 예정이다.
한편 생물의약품을 화학의약품으로 개발한 합성펩타이드 의약품의 경우 아래의 조건을 만족하는 대조약과 비교자료를 제출해야 한다.
대조약은 동일 펩타이드의 최초 허가된 생물의약품을 의미하며 원료의약품에 대한 '구조 결정에 관한 자료', '물리·화학·생물학적 성질에 관한 자료'에 있어서 대조약의 원료의약품과 유효성분의 동일성을 입증할 수 있는 자료를 제출해야 한다.
또 완제의약품에 대한 ‘순도시험에 관한 자료’에 있어서 불순물 프로파일을 마련하고 대조약과 비교한 자료를 제출해야 하며 대조약에도 존재하는 불순물인 경우 그 각각의 함유량은 대조약보다 작거나 같아야 하고, 대조약에 포함되지 않는 새로운 불순물인 경우, 주성분의 0.5% 이해야 하며 주성분의 안전성·유효성에 영향을 미치지 않음을 입증해야 한다.
이와함께 대조약에 존재하는 불순물의 함량이 대조약보다 많거나, 대조약에 존재하지 않는 새로운 불순물의 함량이 주성분의 0.5%를 초과하는 경우에는 '신약, 화학구조 또는 본질조성이 전혀 새로운 신물질 의약품'에 따라 자료를 제출해야 한다.



