임상시험용약 품질자료 요건, 최초 임상시험시 고려사항 등 담아
식약처가 코로나19 백신 임상시험 조기 진입을 돕고 제품화를 지원하기 위한 가이드라인을 발간했다.
주요 내용은 ▲임상시험용의약품의 품질자료 요건 ▲독성시험 등 비임상시험 고려사항 ▲최초 임상시험 시 고려사항 ▲안전성·유효성·면역원성 평가항목 설정 시 고려사항 ▲세계보건기구(WHO) 코로나19 백신 지침(부록) 등이다.
식약처는 'K-백신 신속심사 추진반'을 통해 코로나19 백신 개발 11개 업체에 맞춤형 상담을 제공하고 있으며, 임상시험 단계로 신속히 진입할 수 있도록 지원하고 있다.
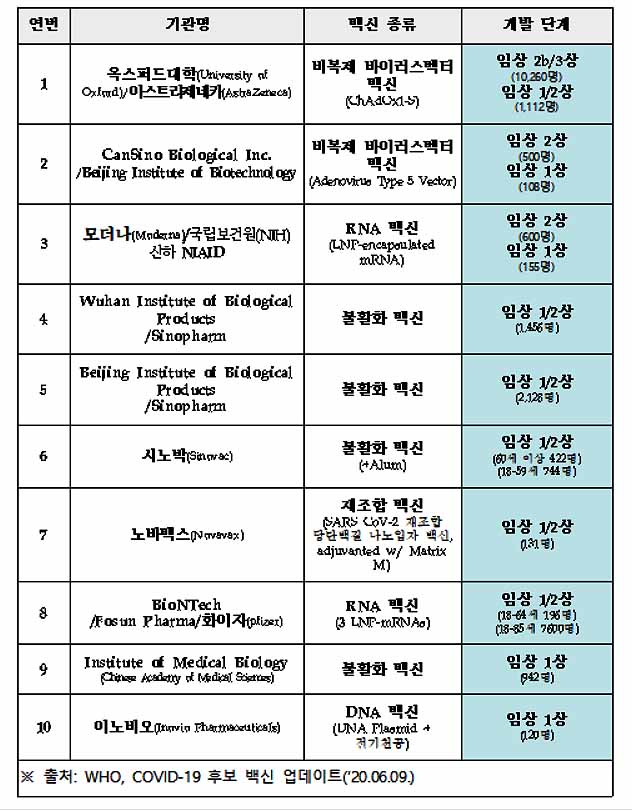
K-백신 신속심사 추진반은 백신 심사를 총괄하는 '전담심사팀', 내‧외부 업무협력 전담 '상황지원팀', 학계‧병원 등의 '외부전문가자문단'으로 구성됐다. 현재 지원현황은 임상 승인 2건, 비임상 개발 단계 9건 등 총 11건 지원 중이다.
저작권자 © 뉴스더보이스헬스케어 무단전재 및 재배포 금지



